
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ее регулирования
|
|
|
|
Химическая кинетика. Скорость химической реакции и методы
Раздел химии, изучающий скорость и механизм химических реакций, называется химической кинетикой. Существуют термодинамически выгодные химические реакции (DG< 0), но протекающие очень медленно кинетически. Примером такой реакции может быть реакция горения графита в кислороде с образованием углекислого газа.
Это происходит потому, что в реакцию вступают не все частицы исходных веществ, а только активные, обладающие достаточной энергией для разрыва связей в исходных частицах и создания новых связей в продуктах реакции. Поэтому каждая реакция характеризуется энергетическим барьером, для преодоления которого нужна избыточная энергия – энергия активации. Энергия активация – избыточная (по сравнению со средней энергией молекул при данной температуре) энергия, которой должна обладать молекулы для того, чтобы их столкновения были эффективны и приводили бы к образованию нового вещества.
Скорость химической реакции – это изменение количества вещества в единицу времени в единице реакционного пространства.
Реакционным пространством гомогенной реакции, (все вещества находятся в одной фазе) является заполненный реагентами объем. Так как отношение количества вещества к единице объема называется концентрацией С, то скорость гомогенной реакции равна изменению концентрации ( DС) исходных веществ или продуктов реакции во времени ( Dt).
Средняя скорость гомогенной реакции (Vср) равна: 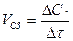
Зависимость скорости реакции от концентрации реагирующих веществ.
Зависимость скорости реакции aA+bB ® cC+dD
от концентрации описывается кинетическим уравнением реакции.
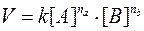 ,
,
где na, nb - порядки реакции по веществам A и B (сумма показателей степеней
концентраций в кинетическом уравнении),
[ А], [В] - концентрации веществ, моль/л.
Если такая реакция протекает в одну стадию, то порядок реакции равен сумме стехиометрических коэффициентов в уравнении реакции и na=a, nb=b и кинетическое уравнение принимает вид:
V =  k×[A]a× [B]b
k×[A]a× [B]b
и называется законом действующих масс.
Например, для реакции:
2NO (г) +О2 (г) ® 2NO2(г) (1) V1= k1×[NO]2×[O2]
Зависимость скорости реакции от температуры
Зависимость скорости реакции от температуры выражена в правиле
Вант-Гоффа: «При повышении температуры на каждые 100С скорость  большинства реакций увеличивается в 2-4 раза»:
большинства реакций увеличивается в 2-4 раза»: 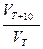 = g
= g
где VТ , VТ+10 - соответственно скорости реакции при температуре Т и T+10
g - температурный коэффициент скорости реакции, g = 2¸4.
В общем случае, если температура изменилась на DТ0C, уравнение принимает вид: 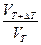 = g DТ/10
= g DТ/10
Зависимость скорости реакции от катализатора.
Альтернативным способом повышения скорости реакции является снижение энергии активации с помощью катализатора – вещества, ускоряющего скорость реакции, но не изменяющегося количественно. Катализаторы снижают энергию активации реакции, увеличивая число активных молекул.
Колебательные реакции
Колебательные реакции - реакции, характеризующиеся колебаниями концентраций некоторых промежуточных соединений и соответственно скоростей превращения. Чаще всего это – окислительно-восстановительные реакции или реакции с появлением новой фазы вещества. Причина возникновения колебаний концентраций – наличие обратных связей между отдельными стадиями сложной реакции: положительных, когда продукт реакции ускоряет ее, и отрицательных, когда в ходе реакции вырабатывается ингибитор ее начальной стадии. Каталитические реакции лежат в основе важнейших биологических процессов: генерации нервных импульсов, мышечного сокращения, генерации биоритмов.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 412; Нарушение авторских прав?; Мы поможем в написании вашей работы!