
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Які основні характеристики і параметри хімічних сенсорів?
|
|
|
|
Як і будь-який мiкроелектронний прилад, напiвпровiдниковi. хiмiчнi сенсори паспортизують, тобто вказують набiр основних параметрів і характеристик. Насамперед, визначимо, що саме вимipюється сенсором.
|
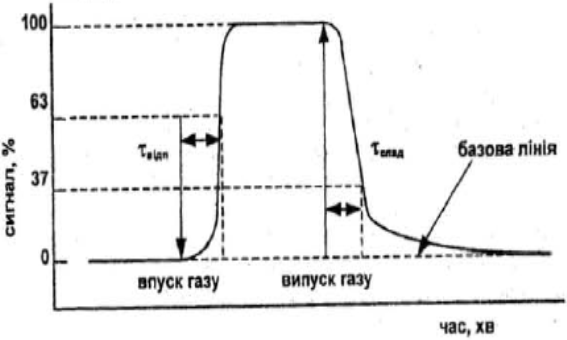
| Рис. 1.4 Типова зміна сигнaлу сенсора пpи впуску та випуску гaзу |
При подачі у вимipювальну камеру, в якiй знаходиться сенсор, певної концeнтpaцiї газу сигнал вiд сенсора змiнюється - зростає до максимального (чи спадає до мiнiмального) значення. Оскільки сигнал від сенсора може вiдрiзнятись вiд нуля навіть за відcyтнocтi в атмосферi газу (наприклад, сенсор резистивного типу завжди має деяке значення опору), то вводять поняття базової лінії - це сигнал сенсора до взаємодії з газом. Вимiрюеться змiна сигналу в абсолютних ( ΔT, Δq, Δm, ΔФ тощо) чи відносних одиницях за умови дії газового середовища (рис. 1.4).
Час відповіді сенсора - це час, за який вихiдний сигнал сенсора досягає 63% від максимальної величини при змiнi концентрації (парціального тиску) вимiрюваного газу від нуля до даної концентрації (парціального тиску). Iнколи вживають інше визначення часу часу відповіді, коли сигнал сягає 90% вiд максимального. Визначають також і час відновлвння - це час, за який вихiдний сигнал падає до 37% (в е разiв), чи до 10% вiд максимального при змiнi концентрації (парціального тиску) вимірюваного газу до нуля.
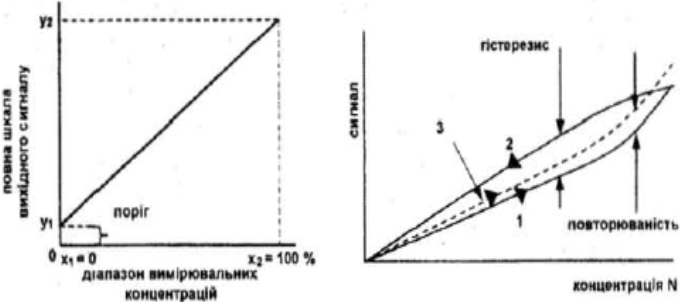
На рис. 1.5 а) представлено гpадуювальну криву у двокоординатнiй системi для найпроcтiшого випадку лiнiйного сенсора, який вимірює зміну оптичнorо чи електричного сигналу при змiнi концeнтpaцiї газу, у даному випадку - відносної. вологостi.
Основними параметрами градуювальної кривої є дiапазон вимiрюваних концентрацій (х1-х2) тобто мiнiмальна х1, i максимальна граничні х2 концентреції газiв, якi можна визначати за допомогою сенсора. Цiй облаcтi (х1-х2) на шкалi сигналiв буде вiдповiдати область (у1-у2). Це так звана повна шкала вихіного сигналу.
|
| Рис. 1.5: а) залежність сигналу лінійного сенсора від вологості; б) до пояснення ефектів гістерезису та повторюваності: 1 - перше вимірювання, коли N зростає, 2 – друге вимірювання, коли N зменшується, 3 - n·циклів вимірювання, коли N зростає. |
Чутливicть сенсора визначається як вiдношення змiни вихiдного сигналу до відповідної змiни вимipюваної концентрації. Тобто, якщо залежність вихiдного сигналу від вхідного описується функцiєю типу y=f(x),то чутливiсть сенсора визначаєтъся як: 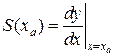 .
.
У випадку лiнiйного відryку сенсора, тобто коли y=kx+b (Де k, b - const) його чутливiсть стала для всього дiапазону вимiрюваних концентрацiй S =k. Величина b= y1 називасться порогом сигналу вiдгуку. Якщо, наприкnад, y=kx2+b, то чутлиеiсть сенсора зростає зi эбiльшенням концентрації S =2 kx.
Лiнійність - це вiдхиnення від прямої лiнiї градуювальної харакreриcтики даного сенсора, яке вимiрюєтъся у відcoткax.
Гістерезис характеристики - це максимальна рiзниця вихiдного сигналу в будь-якiй точцi хі эалежностi y=f(x), яка визначаєтъся при двох послiдовних вимipюваннях, коли концентрацiя газiв зростає та падає (рис. 1.5 б). Гістерезис визначають у вiдсотках до повної шкали вихідного сигналу, тобто Δy(xi)/(y1-y2).
Повторюванicть - це властивiсть сенсора показувати однакові виxiднi характеристики в послiдовностi циклiв вимiрювання й виэнвчається максимальною рiзницею мiж вихiдними сигналами для різних циклiв вимірювання. Так само як i гiстерезис, визначається у відсотках щодо повної шкали вихiдного сигналу (рис. 1.5 б). Повторюваність і відсутність гістерезису визначає високу стабiльнiсть характеристик сенсора.
Селективнiсть - це властивiсть сенсора визначати і вимiрювати тiльки одну хiмічну компоненту за присутностi iнших у суміші газів чи розчинах. У загальному випадку хiмiчнi сенсори характеризуються невисокою селективнiстю, тобто вони є скорiше неселективнi нiж селвктивнi, і одночасно peaгyють на присутність кількох газiв.
Серед iнших параметрів, якi описують функцiонування сенсора, можна вiдзначити шуми, зовнiшнi умови його роботu (температура, вологіcтъ, атмосферний тиск, наявнiстъ в атмосферi iнших газiв, електромагнітні поля, удари, вiбрацiя), гарантiйнuй час рйботи (чи гарантiйна кiлькість циклiв вимipювань газ - повiтря), ціна тощо.
Основними харакreристмками xiмiчних ceнcopiв вважають: чутливість, селективнicть, стабiльнicть характеристики, час вiдповiді, дiaпазон виміpюваниx кoнцентpaцiй, мінiмальна вимірювальна концентрацiя, цiна тощо.
3. Дайте означення понять "адсорбція", "адсорбат", "адсорбент", “ступінь покриття поверхні”. Яка різниця між фізичною та хімічною адсорбцією? Як їх розрізнити експерименально?
Адсорбція - це підвищення концентрації однієї речовини біля поверхні розділу двох фаз, з яких одна зазвичай є твердим тілом. Для того, щоб сенсор вiдчував хiмiчний сигнал, необхiдна взаємодія поверхні сенсора з дослiджyваною хiмiчною спопукою. Робота сенсора може базуватись на використаннi явища адсорбції частинок на поверхні (ad - на, sort>вo - поглинаю). Введемо поняття адсорбату - це молекули газу чи розчиненої в рiдинi речовини, якi концентруються на noвepxнi твердого тiла. В даному випадку тверде тіло називається адсорбентом. Кiлькiсною характеристикою адсорбції є величина Г - надлишок адсорбату, який припадає на одиницю площi поверхневого шару, якщо порiвняти з кiлькiстю адсорбату в одиницi об’єму адсорбенту. Вiдношення θ=Г/Г∞ називається ступенем покрummя пoвepxнi, де Г∞ - максимально можлива величина моношарної адсорбцiї.
В залежностi від характеру взаємодiї молекул адсорбату i адсорбенту розрiзняють фiзичну та хімічну адсорбцii. Фiзична адсорбцiя обумовлена силами мiжмолекулярної взаємодiї, (воднееий эв’язок, сила Ван дер Ваальса) i не супроводжується суттєвою зміною електронної структyри молекул адсорбату. Фiзична адсорбцiя може бути як суб-, моно-, так i багатошаровою. При хiмiчнiй адсорбції мiж атомами (молекулами) адсорбату та адсорбенту вiдбувається обмiн електронами та утворюється хiмiчний зв’язок. У деяких випадках обидва типи адсорбцiї можуть відбуватися одночасно.
Часто процеси адсорбції супроводжуються видiленням теплоти воно тим бiльше, чим сильнiший зв’язок адсорбат-адсорбент. При фiзичнiй адсорбції кiлькiсть теплоти менше 15 кДж/моль; при хемосорбцiї теплота, що видiляється, може змiнюватись у дiапазонi 15-200 кДж/моль. Проте, у випадку дисоцiативноi адсорбцii може спостерiгатися поглинання теплоти. Швидкiсть процесiв адсорбцiї можна описати рiвнянням: 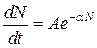 де N ‑ кiлькiсть адсорбованої речовини, А та α - постiйнi, якi залежать вiд температури. Зi збiльшенням кiлькоcтi адсорбованої речовини N швидкiсть адсорбцiї зменшуеться. Отже, експериментально фізичну та хімічну адсорбції можна розрізнити за допомогою кількості теплоти, що виділяється.
де N ‑ кiлькiсть адсорбованої речовини, А та α - постiйнi, якi залежать вiд температури. Зi збiльшенням кiлькоcтi адсорбованої речовини N швидкiсть адсорбцiї зменшуеться. Отже, експериментально фізичну та хімічну адсорбції можна розрізнити за допомогою кількості теплоти, що виділяється.
4. Моделі адсорбції. Рівняння Гібса та ізотермиадсорбції Ленгмюра. Порівняйте висновки з теорії адсорбції Брунауера-Еммета-Теллера та Ленгмюра.
Iснують кiлька моделей, які описують процеси адсорбцї, а саме:
· модель центрової чи локалзованої адсорбцї, згідно з якою на поверхі адсорбенту iснують центри адсорбції, тобто певні дiлянки поверхні на яких утворюється сильний адсоpбцiйний зв’язок або розподiленi по поверхні двомірні комірки зі слабким адсорбційним полем сил мiжмолекулярної взаємодiї. В ocтанньому випадку вважається, що існує щiльна упаковка молeкул адсорбату на поверхні в межах цих комірок;
· модель двовимiрної фази, в якiй адсорбований моношар є неiдеальним двовимiрним газом;
· потенцiальна модель, яка базується на існуванні потенцiального поля поверхнi твердого тiла, в якому адсорбований газ стиснуто поблизу його поверхні та розріджено в зовнішніх шарах.
На основі цих моделей отримано рівняння, які непогано описують експериментальнi результати. Основним термодинамiчним рівнянням, яке описує адсорбцiю, є рівняння Гiббса:
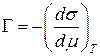 , де Г - надлишок адсорбату, який припадає на одиницю площi поверхневого шару, якщо порiвняти з кiлькiстю адсорбату в одиницi об’єму адсорбенту; σ - поверхневий натяг на межі подiлу; μ - хiмiчний потенцiал адсорбату. Iз рiвнянь Гіббса можна отримати рiвняння для опису процесiв адсорбції за рiзних умов.
, де Г - надлишок адсорбату, який припадає на одиницю площi поверхневого шару, якщо порiвняти з кiлькiстю адсорбату в одиницi об’єму адсорбенту; σ - поверхневий натяг на межі подiлу; μ - хiмiчний потенцiал адсорбату. Iз рiвнянь Гіббса можна отримати рiвняння для опису процесiв адсорбції за рiзних умов.
До цих рiвнянь належать рiвняння ізотерм адсорбції якi описують залежностi кількостi адсорбованої речовини від тиску Р чи концентрації адсорбату N при постiйнiй темпepaтypi. Найпростіша iзотерма - це iзотерма, яку отримав Ленгмюр, прирiвнявши швидкостi адсорбції та десорбцiї за умови енергетично однорiдних поверхонь адсорбенту та за відсутності на поверхні латеральної взаємодiї адсорбованих молекул:
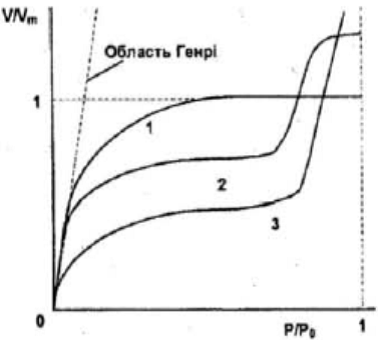
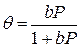 (1.5), де θ називається ступенем покриття пoвepxнi, b - константа, яка залежить від температури та типу взаємодiї адсорбат-адсорбент. При мапих значеннях Р або N, коли bР «1, θ=bP, ізотерма має лiнійну дiлянку, коли cтyпінь покриття лiнiйно зростає при пiдвищеннi концентрацiї адсорбату (так звана область Генрі) (рис. 1.6). При бiльших значеннях Р крива виходить на насичення. Теорiя Ленгмюра справедлива лише для моношарової адсорбції.
(1.5), де θ називається ступенем покриття пoвepxнi, b - константа, яка залежить від температури та типу взаємодiї адсорбат-адсорбент. При мапих значеннях Р або N, коли bР «1, θ=bP, ізотерма має лiнійну дiлянку, коли cтyпінь покриття лiнiйно зростає при пiдвищеннi концентрацiї адсорбату (так звана область Генрі) (рис. 1.6). При бiльших значеннях Р крива виходить на насичення. Теорiя Ленгмюра справедлива лише для моношарової адсорбції.
|
| Рис. 1.6. Пpиклади ізотерм для моношарової (1) і багатошарової (2, 3) адсорбції. |
Для багатошарової адсорбцiї форма iзотерми значно cклaднішa (рис. 1.6, криві 2, З). Такі iзотерми можна пояснити на основі моделей, які враховують полiмолекулярнiсть адсорбцiї. Biдoмa теорія Брунауера-Еммета-Теллера (БЕТ), яка базується на моделі локалізованої адсорбцiї з центрами у виглядi двовимiрних комірок і відсутності латеральної взаємодії. За цiєю теорiєю iзoтерми мають довгі лiнiйнi дiлянки, що вiдповiдaють багатошaровому заповненню поверхні молекулами адсорбатy, а точка iзотерми, з якої лiнiйна ділянка починаєтьcя, вiдпoвiдaє забудовi першoго моношару адсорбованих молекул газу. Рiвняння БЕТ має вигляд:
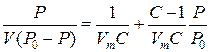 (1.6), де Р0 - тиск насиченої пари адсорбату, V – об’єм адсорбованого газу, Vm – об’єм газу, необxiдний для утворення моношару, nocтiйна С дорінює:
(1.6), де Р0 - тиск насиченої пари адсорбату, V – об’єм адсорбованого газу, Vm – об’єм газу, необxiдний для утворення моношару, nocтiйна С дорінює:
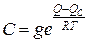 де Q - теплота адсорбцiї, R - унiверсальна газова стала, Т – абсолютна температура, QС - теплота конденсації, g≈1 - статистичний множник. При малих відносних тисках Р/Р0 «1 рiвняння (1.6) переходить у рiвняння Ленгмюра (1.5): V/Vm =θ=bP/(1 +bP), де b=С/Р0.
де Q - теплота адсорбцiї, R - унiверсальна газова стала, Т – абсолютна температура, QС - теплота конденсації, g≈1 - статистичний множник. При малих відносних тисках Р/Р0 «1 рiвняння (1.6) переходить у рiвняння Ленгмюра (1.5): V/Vm =θ=bP/(1 +bP), де b=С/Р0.
Якщо відомі значення площі поперечного перерізу молекул адсорбату, якi знаходяться на поверхні, то за формулою (1.6) можна розрахувати площу поверхні твердого адсорбенту. Використання адсорбатiв ксенону, криптону чи етану при Т=-195ОС дозволяє вимiряти площу поверхні поруватого адсорбенту.
У бiльшостi випадкiв хiмiчнi сенсори розробляють на визначення малих концентрацiй газів, що вiдпоаiдає лiнiйнiй ізотермі (1.5). Проте для деяких газiв (або парів рiдин) необхiднi вимipювання великих концентрацiй. Типовий приклад таких ceнcopiв - це сенсори вологостi.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 541; Нарушение авторских прав?; Мы поможем в написании вашей работы!