
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Самопроизвольное протекание - окислительно-восстановительная реакция
|
|
|
|
Мера окислительно-восстановительной способности системы
ПР. медная пластинка погруженная в р-р собственной соли
Cu2++2e -> Cu0 - восстановл
Cu0 -> Cu2++2e - окисление
______________________________________________________________________________
Окислительно-восст потенциал - мера способности хим вещества присоединять электроны. Окисл-восстан потенциал выражают в милливольтах
Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:
Aox + n·e− → Ared,
то количественная зависимость окислительно-восстановительного потенциала от концентрации(точнее активностей) реагирующих веществ выражается уравнением Нернста.
уравнение Нернста:
 ,
,
________________________________________________________________________________
Длясамопроизвольного протекания окислительно-восстановительной реакции необходимо, чтобы алгебраическая величина потенциала одной сопряженной пары была больше другой и, следовательно, чтобы разность потенциалов сопряженных пар была величиной положительной. Реакция идет до тех пор, пока потенциалы обеих пар не станут равными, после чего в системе устанавливается химическое равновесие.
По аналогии со стандартным электродным потенциалом металла можно ввести понятие стандартного окислительно-восстановительного потенциала, т.е. потенциала восстановительной полуреакции.
Если 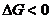 , то процесс протекает самопроизвольно.
, то процесс протекает самопроизвольно.
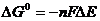 ,
,
т.е. для самопроизвольного процесса необходимо условие:
|
|
|
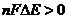
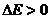
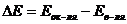
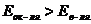 - условие самопроизвольного протекания о/в процесса.
- условие самопроизвольного протекания о/в процесса.
В большинстве случаев для определения направления процессов достаточно воспользоваться стандартными потенциалами, так как концентрация реагирующих веществ влияет незначительно (в пределах 0,1 – 0,2 В).
________________________________________________________________________________Гальванический элемент -химический источник эл. тока, основаный на взаимодействии двух Ме и их оксидов в электролите, приводящем к возникновению в замкнутой цепи эл. тока.
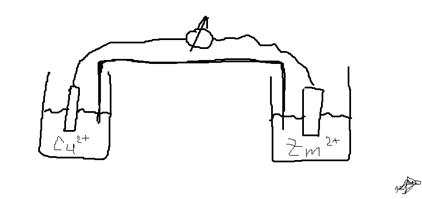
Электрод -эл. проводник, имеющий электронную проводимость и находящийся в контакте с ионным проводником - электролитом. Важной характеристоикой явл. электродный потенциал
Электродный потенц. — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
ЭДС гальванического элемента, состоящего из водородного и исследуемого электродов,измеренная при стандартных условиях называется стандартным электродным потенциалом данного металла. Стандартные электродные потенциалы зависят от природы металлов, концентрации раствора и температуры и имеются в таблицах.
Эта зависимость определяется формулой Нернста:
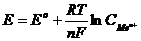
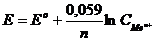
_______________________________________________________________________________
Классификация электродов
1 и 2 род
1) К электродам 1 рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста с концентрацией катиона (к электродам первого рода относят также и водородный электрод)
|
|
|
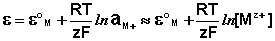
2) к Электродам 2 рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
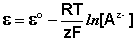
________________________________________________________________________________ Электролиз
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — движутся к катоду, отрицательные ионы — анионы — движутся к аноду.
___________________________________________________________________________
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 1525; Нарушение авторских прав?; Мы поможем в написании вашей работы!