
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы Фарадея
|
|
|
|
è Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
· Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
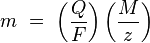
1) m — масса осаждённого на электроде вещества в граммах
2) Q — полный электрический заряд, прошедший через вещество
3) F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея
4) M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль)
5) z — валентное число ионов вещества (число электронов на один ион).
Равновесные потенциалы электродов могут быть определены в условиях отсутствия в цепи тока. При прохождении электрического тока потенциалы электродов изменяются. Изменение потенциала электрода при прохождении тока называется поляризацией:
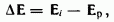
где дельтаЕ — поляризация; Е — потенциал электрода при прохождении тока; Ер — равновесный потенциал.
Термин «поляризация» употребляется не только для обозначения величины изменения потенциала, но и самого явления изменения потенциала при прохождении тока. Так как поляризация может наблюдаться как на катоде, так и на аноде, то различают катодную и анодную поляризации. Измерение потенциала при прохождении тока также называется «перенапряжением». Этот термин обычно употребляют, когда известна причина изменения потенциала. Его также относят к некоторым конкретным процессам, например к катодному выделению водорода (водородное перенапряжение).
_______________________________________________________________________
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 371; Нарушение авторских прав?; Мы поможем в написании вашей работы!