
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приготовление стандартного раствора бихромата калия
|
|
|
|
Лабораторная работа N 7
Бихроматометрическое определение содержание железа
В бихроматометрии стандартным является раствор бихромата калия. В кислой среде бихромат-ион является сильным окислителем, его применяют для определения восстановителей, сам он восстанавливается до иона Cr 3+:
Cr2O7 2- + 14H+ + 6e = 2Cr 3+ + 7H2O,
E0 (Cr2O72-/2Cr 3+) = 1.33 B.
При титровании бихроматом калия применяют окислительно-восстановительные индикаторы – дифениламин, дифенилбензидин и другие.
Реакция между бихромат-ионами и железом (II) протекает в соответствии с уравнением:
Cr2O7 2- + 14H+ + 6Fe 2+ ↔ 2 Cr 3+ + 6Fe 3+ + 7H2O
В процессе титрования повышается концентрация ионов железа (III), потенциал системы Fe3+/Fe2+ возрастает, это приводит к преждевременному окислению индикатора (дифениламина). Если к титруемому раствору прибавить фосфорную кислоту, то окраска индикатора резко изменится в конечной точке титрования. Фосфорная кислота понижает окислительно-восстановительный потенциал системы Fe3+ /Fe 2+, образуя устойчивый комплекс с ионами железа (III).
Растворы солей железа (II) содержат ионы железа (III), поэтому перед титрованием ионы железа (III) необходимо восстановить. Для восстановления применяют металлы (цинк, кадмий), SnCl2, H2S, SO2 и другие восстановители.
Рассчитывают навеску бихромата калия, необходимую для приготовления 250 мл (200 мл) 0.02 М раствора. Навеску взвешивают на технохимических весах, а затем уточняют массу на аналитических весах. Аккуратно, при помощи воронки, переносят навеску в мерную колбу вместимостью 250 (200) мл, растворяют в небольшом количестве дистиллированной воды и разбавляют до метки. Рассчитывают концентрацию бихромата калия, исходя из уточненной навески. Полученным раствором титруют раствор, содержащий железо(II).
Реагенты:
Бихромат калия, K2Cr2O7 0,020 М, (1/6 K2Cr2O7), стандартный раствор;
Хлороводородная кислота, HCl, концентрированная, пл. 1.17 г/мл;
Серная кислота, H2SO4, концентрированная, пл. 1.84 г/мл;
Фосфорная кислота, H3PO4, концентрированная, пл. 1.7 г/мл;
Защитная смесь(смесь кислот H2SO4 и H3PO4);
Цинк металлический, гранулированный;
Индикатор дифениламин, 1%-ый раствор в концентрированной Н2SO4.
Выполнение определения
Аликвотную часть анализируемого раствора 10.00 мл пипеткой вносят в колбу для титрования вместимостью 100 мл, добавляют 7 – 10 мл защитной смеси (или 3 – 4 мл H2SO4 и 5 мл H3PO4), 15 – 20 мл дистиллированной воды, 2 капли раствора индикатора дифениламина и титруют раствором бихромата калия до появления интенсивной фиолетовой окраски.
По результатам трех титрований рассчитывают содержание железа и проводят статистическую обработку результатов анализа.
Расчет результатов анализа:
Массу железа рассчитывают по формуле: 
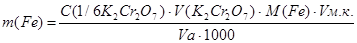
где С (1/6К2Сг207) – молярная концентрация эквивалента бихромата калия.
Vа – объем аликвоты исследуемого раствора соли железа.
M(Fe) – молярная масса эквивалента железа в данной реакции.
Vм.к. – объем мерной колбы.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 5303; Нарушение авторских прав?; Мы поможем в написании вашей работы!