
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Углерод
|
|
|
|
Бор
Паспортные данные бора: он занимает пятую позицию в таблице Менделеева и относится к третьей группе периодической системы, то есть он — уже не металл; атомная масса бора 10,811; у него известны два изотопа с атомными массами 10 и 11; плотность бора2,3 грамма в кубическом сантиметре; температура плавления 2075 градусов Цельсия; бор предстает обычно в мелкокристаллическом виде.
Очень чистый бор бесцветен, однако чистым он практически никогда не бывает и поэтому выглядит чаще всего как темно-серый, бурый или даже как черный. В физическом и, особенно, в химическом отношениях бор очень сильно похож на своего соседа — на углерод: он также соединяется с кислородом, с серой, с азотом, с фосфором, с металлами; соединяются они и между собой. Все эти соединения нуждаются в “поджоге”; при обычной же температуре бор соединяется только со фтором. С азотом и углеродом бор образует сверхтвердые нитриды и карбиды, а с водородом — гидриды, которые по аналогии с углеводородами называют еще бороводородами. Бор может участвовать также в соединениях полимеров.
В топологическом плане переход от конфигурации атома бериллия к конфигурации атома бора — ступенчатый, и поэтому, казалось бы, можно довольно точно указать, границу между их размерами; но на самом деле она не такая уж конкретная: в одном случае она может сместиться в сторону бериллия, в другом — в сторону бора, — поэтому нет смысла искать ее однозначной. Будем считать, что она пролегает где-то между 16 500 и 18 400 связанных электронов. Это — нижняя граница; верхней границы у атома бора нет: он плавно переходит в атом углерода.
Топологию атома бора можно рассматривать как продолжение формообразования атома бериллия, но лучше начать сначала. Итак, при столкновении двух фронтов эфира могло возникнуть микрозавихрение в виде вращающейся торовой оболочки (типа дымового кольца) диаметром приблизительно в 5 900 эфирных шариков. Это кольцо из круглого превращается в овал; при самом наибольшем сплющивании, когда радиусы закруглений на его концах уменьшатся до предельных значений, то есть до 285 шариков, его длина окажется в 30 раз больше этих радиусов. Длинные стороны овала будут продолжать сближаться до полного соприкосновения, а его концевые петли завернутся, будем считать, вверх и устремятся навстречу друг другу. Столкнувшись своими вершинами, петли завернутся еще раз в том же направлении и устремятся внутрь (вниз); погонит их туда присасывание концевых петель. Завершится этот этап тем, что вершины петель упрутся в середину спаренных шнуров; точно так же формируется атом бериллия.
А дальше произойдет следующее. Спаренные шнуры, замыкающие концевые петли, также начнут слипаться между собой и вызовут удлинение атома: из формы, напоминающей яблоко, атом превратится в подобие перца. Указанное слипание спаренных шнуров теоретически должно было бы прекратиться в момент, когда вершины петель упрутся в середину шнуров, но — и в этом весь секрет — слипшиеся петли могут промахнуться и проскочить мимо или, упершись в шнуры, по случайности могут соскочить с них; и тогда слипание спаренных шнуров продолжится. Вывернувшиеся изнутри атома спаренные петли начнут разворачиваться и уходить вверх, а внизу, как следствие, возникнут уже спаренные новые, вторичные петли. Если бы длина торового шнура была достаточной (такой она будет только у атома углерода), то атом бора вытянулся бы в линию, на концах которой располагались бы перпендикулярно ориентированные между собой спаренные петли. Но атом бора еще относительно мал, и его вывернувшиеся в сторону и уходящие вверх спаренные петли замрут в каком-то полуподнятом положении, напоминающем открытый семафор, или шлагбаум, или вождя с поднятой рукой. Произойдет это потому, что вызывающему подъем петель сближению спаренных шнуров окажут сопротивление вторичные петли, исходно спаренные и не желающие размыкаться. (Все эти манипуляции становятся очевидными, если производить их на резиновом кольце.) Так образуется и так выглядит атом бора. Обратим внимание на то, что четыре шнура, соединяющие его разнесенные петли, будут выкрученными.

Охарактеризуем полученный атом бора с точки зрения его присоединительных способностей: у него — четыре петли и два присасывающих желоба; петли — попарно сомкнувшиеся, а желоба — неконтурные и с разворотом (выкрученные).
Между собой атомы бора могут соединяться только с помощью петель. Достаточно иметь повышенную температуру и (или) повышенное давление, чтобы петли атомов раскрылись и начали перекрестно соединяться между собой. Раскрытию петель способствуют выкрученные шнуры; они после такого раскрытия становятся прямыми, но одна из пар петель вынуждена при этом развернуться так, что ее присасывающие воронки оказываются снаружи, а сами петли расходятся веером.
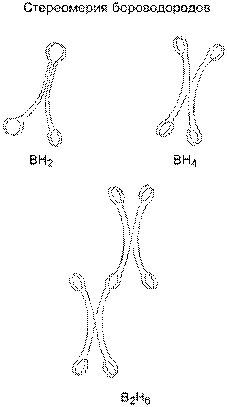 Стереометрия бора принципиально ни чем не отличается от стереометрии углерода; более того, атомы бора могут соединяться с атомами бора вперемежку, образуя хорошо известные три аллотропических модификации: пространственную, плоскостную и линейную. Атом бора может присоединить к четырем своим петлям четыре атома водорода; возможны также сложные петлевые соединения в одну молекулу нескольких атомов бора и нескольких атомов водорода в самых замысловатых комбинациях. Петлевые соединения атомы бора могут образовывать с атомами всех тех химических элементов, которые имеют также петли, то есть с неметаллами.
Стереометрия бора принципиально ни чем не отличается от стереометрии углерода; более того, атомы бора могут соединяться с атомами бора вперемежку, образуя хорошо известные три аллотропических модификации: пространственную, плоскостную и линейную. Атом бора может присоединить к четырем своим петлям четыре атома водорода; возможны также сложные петлевые соединения в одну молекулу нескольких атомов бора и нескольких атомов водорода в самых замысловатых комбинациях. Петлевые соединения атомы бора могут образовывать с атомами всех тех химических элементов, которые имеют также петли, то есть с неметаллами.
С атомами металлов атомы бора могут соединяться только с помощью присасывающих желобов; при этом его желоба вынуждены выпрямляться (избавляться от выкрученности) и раскрывать с одной стороны петли, а открытые петли, то есть петли с открытыми присасывающими воронками, ведут себя агрессивно: они готовы присосаться к первой попавшейся петле и при том даже высвобождают тепло. Соединение атомов бора с помощью желобов может осуществляться не только с атомами металлов, но и с атомами других химических элементов, у которых есть присасывающие желоба; а такие соединения могут иногда вызывать распрямление атомов бора в первоначальный длинный овал с двумя петлями на концах; такой вытянувшийся атом бора может опутывать другие атомы самым замысловатым образом.
Соединение петлями — наиболее прочное, поэтому пространственные модификации из атома бора тоже очень прочные; этому способствует еще и то, что атомы бора образуют очень простые, прямоугольные конструкции (кубические кристаллы), в которых могут отсутствовать случайные искажения — так называемые дислокации. Тепловые движения атомов поглощаются их прямыми участками и почти не затрагивают петель; отсюда — довольно высокая температура плавления. Плотность бора, определяемая расположением шнуров в межатомных соединениях, не очень высокая, но все же выше чем у бериллия, в 1,24 раза.
Идеально построенные кубические кристаллы бора имеют такую простую решетку, сквозь которую может свободно проникать свет; такие кристаллы прозрачны. Сквозь искаженные кристаллы или кристаллы с вкраплениями атомов других химических элементов свет свободно проникать не может и поглощается атомами; отдают они его уже на более низких частотах красного спектра или даже в невидимом инфракрасном диапазоне, — все зависит от собственных частот прямых участков между концевыми петлями; такие кристаллы либо бурые, либо даже черные.
Углерод занимает шестую позицию в таблице Менделеева; его атомная масса равна 12,011. При обычных условиях он химически инертен, при высоких температурах соединяется со многими элементами. Температура плавления углерода равна 4020 градусов Кельвина. В природе известны в основном две кристаллические формы углерода — алмаз и графит.
Алмаз — полиморфная модификация углерода; в виде кубической сингонии алмаз бесцветен, но его октаэдрические кристаллы приобретают окраску. Плотность алмаза равна 3, 5 грамма в кубическом сантиметре. Он — самый твердый природный материал, обладает высоким показателем оптического преломления и в виде крупных кристаллов относится к числу драгоценных камней. Алмаз — полупроводник.
Графит — наиболее распространенная и устойчивая гексогональная полиморфная модификация углерода, имеющая чешуйчатые агрегаты. Цвет графита — от темно-серого до черного. Его плотность равна 2,2 грамма в кубическом сантиметре. Графит огнеупорен (изделия из него выдерживают температуру в 3700 градусов Цельсия) и вообще химически стоек; он обладает электропроводностью. В технике он используется в качестве твердой смазки.
Известны также линейные полимеры углерода — карбин и поликумулен; они представляют собой высокопрочные нити, которыми армируют композиционные материалы. Карбин обладает полупроводниковыми свойствами: под действием света его проводимость сильно увеличивается.
Углерод может соединяться с металлами, образуя карбиды. Карбиды вольфрама, титана, тантала и ниобия очень тугоплавки, тверды, износостойки, жаропрочны; из них изготовляют пластины режущих инструментов; детали из карбидов используют в турбинах и реактивных двигателях.
Но больше всего известны органические соединения углерода: они являются основной составной частью растительного и животного мира. Все горючие ископаемые — нефть, газ, торф, сланцы — построены на углеродной основе; особенно богат углеродом каменный уголь. Кроме природных существует множество искусственных полимеров на основе углерода. Общее число известных науке органических соединений превышает 7 миллионов.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 691; Нарушение авторских прав?; Мы поможем в написании вашей работы!