
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина. Теоретична маса нанесеного оксиду, см3 :
|
|
|
|
Висновки
Результати
Методика розрахунку
Теоретична маса нанесеного оксиду, см3:

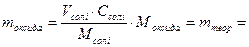 , г
, г
де  - об’єм солі, що увібрався носієм, см3;
- об’єм солі, що увібрався носієм, см3;
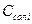 - концентрація безводної солі, г/см3;
- концентрація безводної солі, г/см3;
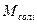 - молярна маса безводної солі, г/моль;
- молярна маса безводної солі, г/моль;
 - молярна маса оксиду (активного компонента), г/моль.
- молярна маса оксиду (активного компонента), г/моль.
Практична маса нанесеного оксиду,г:

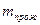 - маса каталізатора після прожарювання, г;
- маса каталізатора після прожарювання, г;
 - маса носія до просочування, г.
- маса носія до просочування, г.
Тоді вихід за активним компонентом складе:

Для розрахунків необхідно користуватися довідниковими даними наведеними в таблиці 2.2.
Таблиця 2.2
| Речовина | Cu(NO3)2 | Cu(NO3)2∙3H2O | Co(NO3)2∙ | Co(NO3)2∙6H2O |
| Молярна маса, г/моль | 187,5 | 241,5 | ||
| Розчинність солі при 293К (г безводної солі/100 г розчину) | - | 62 (313 К) | - | 49,3 |
Необхідно розрахувати вихід каталізатора отриманого методом просочування.

3 Лабораторна робота:
Одержання каталізаторів методом електрохімічного осадження активних компонентів на сітчастому носії
Мета роботи: одержання каталізатору сітчастого типу шляхом електролітичного осадження активного компоненту
3.1 Короткі теоретичні відомості
Деякі хіміко-технологічні процеси передбачають використання в якості каталізаторів дорогоцінних металів – платини, паладію, золота тощо. Беручи до уваги те, що в хімічному перетворенні приймає участь лише поверхневий шар металу, виплавляння подібних сіток є економічно недоцільним. Досить логічним є рішення наносити шар активного компоненту на сітчасту основу. Одним з методів такого нанесення є електролітичне осадження дорогоцінного металу на поверхні струмопровідної підкладки.
В основі процесу електролітичного осадження лежать явища, що виникають під час пропускання електричного струму через водний розчин солі дорогоцінного металу, тобто електролізу.
Електроліз (від електро- і -лізіс – розпад; рос. - электролиз, англ. - electrolysis, нім. - elektrolyse) – розклад речовин (наприклад, води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом. У 1800 р. англійські дослідники Нікольсон і Карлейль відкрили електроліз: вони встановили, що під час проходження постійного струму у воді чи водних розчинах вода розкладається на водень і кисень. Пізніші дослідження були завершені у 1833 р. Майклом Фарадеєм у вигляді законів.
Електроліз власне полягає в електрохімічних процесах окиснення та відновлення на електродах. У випадку електролізу розчину дорогоцінного металу позитивно заряджені іони (катіони) рухаються до катода, на якому електрохімічно відновлюються. Негативно заряджені іони (аніони) рухаються до анода, де електрохімічно окиснюються. В результаті електролізу розчину дорогоцінного металу на катоді буде одержано шар чистого металу. Таким чином, застосувавши в якості катоду металеву сітку, одержимо покриття дорогоцінним металом-каталізатором з надзвичайно розвиненою поверхнею при мінімальній його витраті.
Обладнання та реактиви
| Випрямляч змінного струму з амперметром | 1 шт. |
| Провідники з‘єднувальні, з ізоляцією, клемами та затискачами | 2 шт. |
| Стакан хімічний на 50 або 100 см3 | 1 шт. |
| Анод графітовий | 1 шт. |
| Розчин солі металу для осадження | >25 см3 |
| Розчин кислоти нітратної 20% | 20 см3 |
| Сітка ніхромова | 2x2 см |
| Ножиці для розрізання металу | 1 шт. |
| Лінійка, збільшуване скло, голка, папір фільтрувальний | 1 шт. |
Техніка безпеки. Під час виконання роботи слід звертати особливу увагу на електричний фактор небезпеки. Перед початком роботи слід обов‘язково впевнитися у відсутності пошкоджень ізоляції провідників та приладів. Електролізер має бути обов‘язково заземлений, механічні пошкодження корпусу електролізеру або вимірювальних приладів не допускаються. Під час роботи не слід торкатися з‘єднань провідників або самих електродів. Після закінчення роботи слід обов‘язково впевнитися у тому, що лабораторну установку знеживлено. У випадку виникнення незапланованих ситуацій під час виконання роботи необхідно вимкнути напругу установки за допомогою загального вимикача.
Процес виготовлення каталізатора сітчастого типу можна поділити на наступні стадії:
1. Підготовчий етап:
- підготовка розчину солі для електролізу;
- підготовка сітки.
2. Електроліз.
3. Заключна обробка:
- промивання;
- сушіння;
- прожарювання;
Експериментальна установка складається з джерела струму та власне електролізера. Схему експериментальної установки наведено на рисунку 3.1

1 – випрямляч, джерело струму; 2 – електролізер;3 – анод графітовий;
4 – катод металевий (сітка)
Рисунок 3.1 – Схема лабораторної установки
Виконання експерименту:
1. За допомогою лінійки і ножиць для металу вирізати зразок сітки 1х1 см.
2. Зразок сітки обробити розчином нітратної кислоти протягом 3 хвилин. Після обробки сітки не можна торкатися руками або забруднювати іншим чином.
3. Промити зразок сітки дистильованою водою, просушити на фільтрувальному папері та зважити на аналітичних терезах.
4. За вказівкою викладача приготувати розчин для електролізу необхідної концентрації. Об’єм розчину має бути достатнім для того щоб повністю покрити підготований зразок сітки у обраному хімічному стакані.
5. Розчин електроліту перенести у хімічний стакан – електролізер.
6. Помістити у електролізер з розчином графітовий анод та приєднати до позитивного затискача джерела струму.
7. Обережно приєднати зразок сітки до негативного затискача джерела струму та помістити його у розчин так, щоб він був повністю у нього занурений, але не торкався графітового аноду.
8. Ввімкнути напругу живлення та задати величину сили струму ~1А.
9. Проводити електроліз протягом 15 хвилин. Весь час контролювати силу струму.
10. Одержаний зразок обережно промити дистильованою водою.
11. Зразок просушити при температурі 423 К протягом 1 год.
12. Прожарювати зразок протягом 2 год. при температурі 1173 К.
13. Зважити зразок на аналітичних терезах.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 579; Нарушение авторских прав?; Мы поможем в написании вашей работы!