
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина. 4 Лабораторна робота: Одержання активного оксиду алюмінію осадженням з розчину
|
|
|
|
Висновки
Результати
4 Лабораторна робота:
Одержання активного оксиду алюмінію осадженням з розчину
Мета роботи: дослідження впливу умов одержання оксиду алюмінію та розрахунок виходу продукту.
4.1 Короткі теоретичні відомості
Стійкі кристалічні форми оксиду алюмінію α-Al2O3, γ-Al2O3 знайшли широке застосування у виробництві адсорбентів та каталізаторів. Конверсія природного газу водяною парою, очищення викидних газів від оксидів азоту, гідрогенізація домішок сірки в природному газі, осушування газів – це далеко неповний перелік процесів, де використовується оксид алюмінію як носій каталізатора, каталізатор або адсорбент.
Поміж модифікацій Al(OH)3, найчастіше зустрічається гібсид (гідраргіліт), що входить до складу деяких бокситів, нордстрандит та байерит. Моногідроксид алюмінію відомий у двох модифікаціях діаспор α-AlOОН γ-AlOОН.
Залежно від кристалографічної структури оксиди алюмінію мають декілька модифікацій: α, γ, θ, δ та ін. Активний оксид алюмінію γ-Al2O3 має розвинену питому поверхню (120-150 м2/г), поруватість 50 – 70 % та високу міцність. Корунд α-Al2O3 – найбільш стійка форма оксиду алюмінію – є механічно та термічно міцним носієм, стійким до дії кислот та лугів. Поруватість його змінюється від 5 до 25 %, питома поверхня невелика (1 – 2 м2/г).
Оксиди алюмінію отримують дегідратацією різних гідроксидів. При проведенні дегідратації на повітрі послідовність стадій можна зобразити наступною схемою:


Таким чином, основною реакцією одержання активного оксиду алюмінію є дегідратація беміту. Умови осаджування гідроксидів, температура та час пропікання обумовлюють питому поверхню оксидів алюмінію.
Схематично метод одержання оксиду алюмінію має вигляд: розчинення солі алюмінію та осаджувача → старіння → промивання → грануляція → сушіння → пропікання. Вихідними розчинами можуть бути алюмінат натрію, азотнокисла або сірчанокисла солі алюмінію. Найбільш розповсюдженим осаджувачем є гідроксид амонію.
Осаджений при невисоких температурах гідроксид алюмінію є аморфним і демонструє картину погано викристалізованого беміту, так званого псевдобеміту. Одночасно з гідролізом основних солей алюмінію відбувається кристалізація гідроксиду. Хімічний склад, форма та розмір часток гідроксиду залежать від умов старіння: при підвищених температурах та високих рН утворюються порівняно великі (до 20 мкм) частки тригідрату-байериту. З підвищенням температури та рН під час старіння швидкість кристалізації гідроксидів підвищується, при цьому вона вища для псевдобеміту, ніж для байериту.
Осадження зі змінним рН (доливання розчину одного з компонентів у розчин іншого) сприяє утворенню суміші осадів різного складу. Осадження при постійному рН реалізується шляхом одночасного зливу розчинів реагентів у реактор з інтенсивним перемішуванням.
Осадження можна проводити у двох режимах: періодичному та безперервному.
В першому варіанті в процесі постійне тільки значення рН, концентрація осадів і солей в маточному розчині змінюється.
В другому варіанті всі параметри системи, а отже, склад осадів зберігається постійними протягом всього осадження завдяки безперервному відводу продуктів осадження. Встановлено, що осадження в безперервному режимі сприяє одержанню кристалічних осадів гідроксиду алюмінію з великою питомою поверхнею (до 200 м2/г), при цьому довге старіння не потрібне.
Перетворення псевдобеміту в γ-Al2O3 в інтервалі 573 – 1023 К не супроводжується значними змінами поверхні, тому питома поверхня γ-Al2O3, одержаного пропіканням псевдобеміту, є функцією поверхні вихідного матеріалу. Висока термостійкість такого оксиду алюмінію робить його цінним компонентом каталізаторів, що експлуатуються при температурах вище 673 К.
Використання гідроксиду байеритної структури як вихідного матеріалу дозволяє приготувати каталізатори з високою розвиненою поверхнею, але оксид алюмінію, одержаний з байериту, менш термостійкий, ніж одержаний із псевдобеміту.
Реактиви та обладнання: штатив, склянка Маріота, крапельний насос, мішалка, склянки місткістю 250 см3 та 500 см3, 2 циліндри місткістю 100 см3 кожний, лійка Бюхнера, сіль алюмінію (кристалогідрат), розчин гідроксиду амонію (з концентрацією 10%), фільтрувальний папір, випарювальна чашка місткістю 100 см3.
Приготувати розчин солі алюмінію з заданою викладачем концентрацією.
Провести осадження гідроксиду алюмінію на установці, зображеній на рис.4.1.
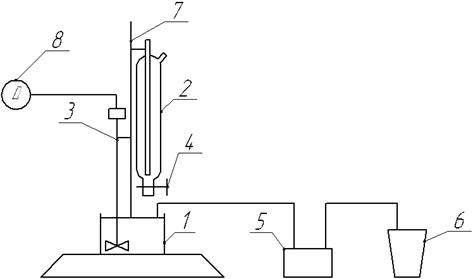
1 – стакан; 2 – cклянка Маріота; 3 – мішалка; 4 – кран; 5 – крапельний насос; 6 – склянка для розчину солі алюмінію; 7 – штатив; 8 – двигун.
Рисунок 4.1 - Схема установки для одержання гідроксиду алюмінію
Для цього треба залити розчин гідроксиду амонію у склянку Маріота 2 та розчин солі алюмінію (з розрахунку на одержання 2 – 5 г Аl2О3) в склянку для подачі розчину в стакан 1, де якому здійснюється безпосередньо процес осадження. Ввімкнути крапельний насос 5 і задати швидкість подачі розчину 2 см3/хв, відкрити кран склянки Маріота 4. Після того, як розчини заповнять дно склянки 1 ввімкнути мішалку 3. В той час, коли кількість розчину гідроксиду амонію у склянці Маріота зменшиться удвічі, необхідно збільшити швидкість його подачі, відкривши кран склянки. Після закінчення процесу осадження вимкнути мішалку та зафіксувати рН осадження за допомогою індикаторного паперу. Далі осад необхідно відфільтрувати на лійці Бюхнера та промити там же осад дистильованою водою. Осад перенести у фарфорову чашку (попередньо зважену) та помістити в сушильний шкаф при температурі 373-393 К на 15 хв. Далі помістити чашку в муфельну піч при температурі 753-823 К на 30 хв, після чого зважити, попередньо охолодивши її в ексикаторі. Після цього знову поставити у муфельну піч на 15 хв і знову зважити. Прожарювання необхідно повторювати до тих пір, поки різниця між зважуваннями буде не більше 0,2г.
4.3 Методика розрахунків
Для приготування робочого розчину солі алюмінію можна використати сіль Al(NO3)3 ∙ 9H2O.
Розрахуємо кількість речовини  яку необхідно отримати
яку необхідно отримати
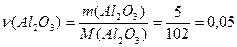 моль,
моль,
де 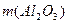 - маса
- маса  після прожарювання (задається викладачем, наприклад, 5 г),,
після прожарювання (задається викладачем, наприклад, 5 г),, 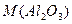 - молярна маса оксиду алюмінію, 102 г/моль.
- молярна маса оксиду алюмінію, 102 г/моль.
Основні реакції отримання активного оксиду алюмінію можна записати у вигляді наступних рівнянь:
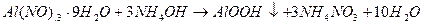 (4.1)
(4.1)
 (4.2)
(4.2)
Таким чином, для отримання 1 моль оксиду за стехіометрією необхідно 2 моль кристалогідрату.
 .
.
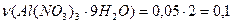 моль
моль
Звідки знаходимо масу кристалогідрату:
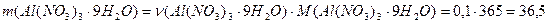 г,
г,
де 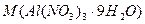 - молярна маса кристалогідрату, 365 г/моль.
- молярна маса кристалогідрату, 365 г/моль.
Об’єм розчину кристалогідрату необхідний для отримання 5 г  , осадженням з розчину певної концентрації С1 (задається викладачем, наприклад, 80 г
, осадженням з розчину певної концентрації С1 (задається викладачем, наприклад, 80 г  /л)
/л)
 см3
см3
Приготувати такий об’єм розчину досить важко, тому перерахуємо масу кристалогідрату необхідну для отримання розчину об’ємом найближчим до об’єму стандартної мірної колби, в даному випадку на 100 см3.
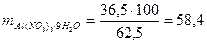 г.
г.
Для приготування розчину беремо наважку кристалогідрату 58,4 г, кількісно переносимо в колбу на 100 см3, доводимо до мітки дистильованою водою. Для отримання оксиду відберемо розрахований об’єм, тобто 62,5 см3.
Об'єм розчину гідроксиду амонію V2, см³, можна орієнтовно розрахувати згідно з реакцією 4.1.

 см³.
см³.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 674; Нарушение авторских прав?; Мы поможем в написании вашей работы!