
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 3. Виды коррозии и их характеристика
|
|
|
|
1.1. Кислородная коррозия металла в водной н газовой средах
На поверхности металла в условиях эксплуатации при работе и останове оборудования в период контакта с водной средой возникает множество анодных и катодных участков, создающих условия для протекания коррозионных процессов. Анодными участками являются зерна феррита, катодными - всевозможные включения в структуру металла, окалина и ржавчина на поверхности металла, потенциал которых значительно выше потенциала железа. На аноде происходит растворение металла, например железа по реакции:
2Fe-4e=>2Fe2+
На катоде идет деполяризация электронов молекулами кислорода
О2+4ё+2Н2О=4ОН-
В процессе отвода электронов от катодного участка (процесс деполяризации) создаются предпосылки для развития коррозии, так как деполяризация катодного участка позволяет поддерживать разность потенциалов между катодом и анодом уменьшается и может упасть до нулевых значений при которых процесс коррозии прекращается.
На анодном участке накапливаются продукты коррозии - ионы Fe2+, на катодном участке - ионы ОН, Там, где встречаются продукты катодной и анодной реакции, образуется гидрат закиси корродирующего металла
Fe2+ + ЮН- => Fe(OH)2
Образование осадка Fe(OH)2 при работе макропар обычно происходит в толще раствора, но в случае работы микропар можно ожидать образования гидрооксида металла на корродирующей поверхности [17].
В процессах коррозии металлов кислород выполняет двойственную роль: во-первых, может выступать в роли деполяризатора катодных участков коррозионных элементов при условии, что катодный процесс является контролирующем фактором, во-вторых, с повышением концентрации и при отсутствии депассиваторов кислород способствует окислению металла и образованию защитных оксидных пленок. При низких концентрациях весь молекулярный кислород восстанавливается на металлической поверхности и действует как простой деполяризатор. При увеличении содержания кислорода в воде в присутствии депассиваторов скорость коррозии стали увеличивается пропорционально его концентрации (рис.1.1).

При повышении рН до 9,6 скорость коррозии при отсутствии кислорода практически равна нулю. Растворение железа в воде, по данным автора [1], при рН<9,6 продолжается до достижения концентрации оксидов железа в растворе, соответствующей пределу насыщения. При этом значение рН возрастает за счет перехода железа в раствор. Двухвалентное железо в растворе окисляется кислородом воздуха
2Fe(OH)2 +1 / 2О2 + ЩО О 2Fe(OH)3 (1-4)
при этом рН среды снижается, стимулируя дальнейшее развитие процесса коррозии.
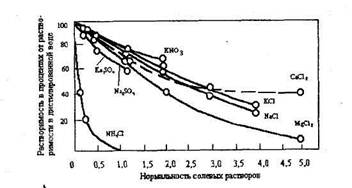
С ростом концентрации солей растворимость кислорода падает (рис. 1.2), а так как коррозия большинства металлов, в частности железа, идет в этих растворах с кислородной деполяризацией, скорость кислородной коррозии, в этом случае при прочих равных условиях значительно уменьшается.
Способность сплавов пассивироваться под действием кислорода зависит от их состава. Так, с увеличением содержания хрома в сталях область возможного пассивного состояния значительно расширяется.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 530; Нарушение авторских прав?; Мы поможем в написании вашей работы!