
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лечение 3 страница
|
|
|
|
Выраженная желтуха, наблюдается преимущественно у недоношенных, у которых гипербилирубинемия нередко требует заменного переливания крови. Увеличение размеров печени и селезенки выявляется у каждого третьего ребенка.
Генерализованную ХИ у новорожденного можно заподозрить на основании наличия у матери цервицита, и септического состояния у ребенка с признаками тяжелой пневмонии (или РДСН) и наличием конъюнктивита, ДВС-синдрома. При рентгенологическом исследовании выявляют грубые перибронхиальные изменения, перекрывающие тень сердца, обусловленные преимущественным поражением верхних дыхательных путей и бронхов.
В крови наблюдается снижение уровней Hb и эритроцитов, длительно сохраняющийся относительный нейтрофилез, увеличение к концу 1-2 недели жизни числа эозинофилов и моноцитов. У детей с выраженными изменениями со стороны ЦНС, сердечно-сосудистой и дыхательной систем в крови может определяться высокий титр антихламидийных антител - 1:64 и более. У глубоко недоношенных новорожденных специфические антитела в раннем неонатальном периоде отсутствуют.
Одной из наиболее часто встречающихся форм ХИ является конъюнктивит. По данным ВОЗ. (1987), он встречается у 14 на 1000 новорожденных. Конъюнктивит развивается после 4-го дня жизни, чаще через 1-2 недели после рождения и характеризуется торпидным течением. Отмечается диффузная гиперемия конъюнктивы, особенно в хрящевом отделе, без перехода на роговицу. Склеивание век после сна, псевдомембранозные образования, отсутствие обильного гнойного отделяемого - характерны для хламидийного конъюнктивита. Продолжительность заболевания 3-4 недели без ухудшения зрения. Поражение двустороннее. Лечение длительное. В стационарах возможны вспышки хламидийного конъюнктивита.
При ХИ часто развиваются пневмонии. Интерстициальные пневмонии нередко проявляются в сроки от 2 недель до 4 мес. после рождения. Дети, заболевшие хламидийной пневмонией, чаще рождаются с оценкой по шкале Апгар менее 6 баллов. У них отмечается РДСН, около 30% из них нуждается в проведении ИВЛ. У большинства больных выявляется гепатоспленомегалия, у 50% выраженные отеки. В половине случаев регистрируется патологическая первоначальная убыль массы тела. У многих выявляются признаки морфофункциональной незрелости к сроку гестации. У всех детей с первых дней жизни в мазках соскобов из ВДП и в легочных аспиратах определяется хламидийный антиген.
В отличие от детей более старшего возраста хламидийная пневмония у недоношенных проявляется на 5-7 день жизни, протекает па фоне тяжелого токсикоза, что сочетается с обнаружением хламидийного антигена в крови, трахеальном аспирате. Отмечается бледный и «мраморный» рисунок кожи, угнетенное функциональное состояние ЦНС, вздутие живота, срыгивания. Часто обнаруживается увеличение лимфатических узлов, иногда кратковременная точечная сыпь. Аускультативно - дыхание пуэрильное или несколько ослабленное, рассеянные хрипы. Имеется диссоциация между выраженной одышкой и относительно скудными физикальными и рентгенологическими данными.
Рентгенологически выявляется интерстициальная пневмония, усиление сосудистого рисунка, понижение пневматизации легочных полей, больше справа. В остром периоде характерна перегрузка правых отделов сердца. На 2-3 неделе присоединяется кашель - приступообразный, влажный, с отхождением мокроты. Гемограмма - лейкоцитоз до 17-23 тыс. со сдвигом формулы влево до миелоцитов, эозинофилия. У старших детей - гиперкапния и гипоксия (рСО2 более 50 мм рт. ст., рО2 < 60 мм рт. ст.).
Заболеванию свойственно затяжное течение. Прогноз у недоношенных детей в связи с иммунодефицитным состоянием более серьезный.
Из других проявлений ХИ для недоношенных свойственны: хламидийный хориоретинит, средний отит, тубоотит, назофарингит, миокардит, бронхит.
На первом году жизни у таких детей выявляется высокий процент ослабленных детей, часто страдающих респираторными заболеваниями. Часты нарушения функции ЖКТ в виде срыгиваний, снижения аппетита, неустойчивого с гула. Девочки страдают вульвитом. При отсутствии специфического лечения отмечена персистенция хламидий. Излечение возможно при комплексной длительной терапии в условиях стационара (эритромицин в сочетании с антиоксидантами, интерфероном, иммуноглобулинами в течение 21 дня).
Диагноз. Показания к обследованию беременных: а) наличии воспалительных заболеваний гениталий, б) наличие бесплодия, в) беременные с отягощенным акушерским анамнезом (самопроизвольные выкидыши, невынашивание, рождение маловесных детей, отягощенное течение беременности, многоводие, неясные лихорадки). У женщин основное значение имеет лабораторная диагностика, т.к. урогенитальный хламидиоз протекает бессимптомно (малосимптомно).
Наиболее объективный метод исследования ХИ (золотой стандарт) - культуральный. Весьма информативен метод гибридизации ДНК (использование ДНК-зонда, меченного биотином). В настоящее время очень широко используется метод ПЦР, иммуноферментный анализ, методы непрямой и прямой иммунофлюоресценции с использованием тест систем иммунохроматографии (методы простые, но точность результатов ниже, чем при использовании ПЦР, метода гибридизации ДНК). Серологические методы являются дополнительными при диагностике ХИ. На текущий и манифестный процесс указывают антитела IgA.
Диагноз ХИ у новорожденных следует заподозрить при:
1. Наличии у матери частых выкидышей, трубного бесплодия, хронического вялотекущего сальпингоофорита, эндометрита, повышения количества лейкоцитов в мазках отделяемого из половых путей и, особенно, при развитии хориоамнионита;
2. Обнаружении цитоплазматических включений или элементарных телец всоскобе из цервикального канала, уретры у беременных, мазках из родовых путей и периферической крови у рожениц и родильниц методом молекулярной гибридизации, ELISA-YICTOJJOM с использованием моноклональных антител, микроиммунофлюоресцентным метолом.
Диагноз ХИ у новорожденных устанавливается при наличии соответствующих проявлений заболевания, а также на основании результатов клинических анализов крови и результатов исследования иммуноглобулинов в динамике, плаценты, рентгенографического и эхокардиографического обследования, УЗИ мозга.
У детей показано проведение микробиологического обследования при рождении и на 5-6 день жизни. При этом наибольшая частота выделения возбудителя наблюдается при исследовании материала с задней стенки глотки.
Окончательный диагноз ХИ устанавливают после обнаружения возбудителя и серологического исследования.
Лечение. Новорожденным с ХИ назначают эритромицинпо 40 мг/кг/сут в течение 3 недель. Для лечения используют также: кларитромицин, азитромицин, рокситромицин. Имеются сообщения о целесообразности сочетания перечисленных антибиотиков с курсами виферона. При отсутствии специфического лечения или при назначении эритромицина в течение 7-10 дней отмечена персистенция хламидий у новорожденных. Излечение возможно при комплексной, длительной терапии (21 день) в условиях стационара.
При конъюнктивите применяют 0,5% эритромициновую мазь с частотой 5-6 раз в сутки в течение 14 дней.
 |
Микоплазменные инфекции (МИ) - острые инфекционные заболевания человека и животных, вызываемые микоплазмами. У женщин с микоплазменной инфекцией внутриутробное инфицирование плода происходит в 96% случаев.
Этиология. Большинство микоплазм являются условно-
патогенными микроорганизмами. В настоящее время их принято относить к бактериям. Микоплазмы способны как к внутриклеточному, так и внеклеточному размножению. Патогенность микоплазм определяется большой их подвижностью и способностью прикрепляться к различным клеткам хозяина, оказывая токсическое и деструктивное действие.
Патогенез. Уникальные биологические свойства микоплазм позволяют им персистировать в организме хозяина, вызывая хронические воспалительные процессы и аутоиммунные патологические состояния.
В зависимости от периода внутриутробного развития плода под воздействием микоплазм могут возникать эмбриопатии, фетопатии и генерализованный инфекционный процесс. Эмбриопатии приводят к формированию пороков развития и нередко являются причиной спонтанных абортов. При фетопатиях микоплазменной этиологии возможно возникновение пороков развития, которые являются результатом пролиферативных и альтеративных процессов, приводящих к сужению каналов и отверстий. Инфицированные околоплодные воды вызывают спазм сосудов плаценты, что приводит к уменьшению кровоснабжения плода, развитию внутриутробной гипоксии, задержке развития и гибели плода.
При заражении плода после 27 недель гестационного периода плод приобретает способность к специфической реакции на внедрение возбудителя инфекции в виде лейкоцитарной инфильтрации, тканевых и гуморальных изменений.
Для гематогенного (трансплацентарного) пути инфицирования характерна полиорганность поражения (печени, легких, ЦНС, перикарда, кожи), которая обусловлена как вегетацией самого возбудителя, так и воздействием продуцируемого экзотоксина. Развитие генерализованного инфекционного процесса происходит под влиянием таких провоцирующих факторов, как внутриутробная гипоксия, асфиксия, родовая травма и т.д.
Инфицирование плода может возникать и во время прохождения плода по родовым путям. Входными воротами инфекции чаще всего является слизистая глаз, половых органов (у девочек) и дыхательных путей. Наиболее выраженные изменения отмечаются в органах дыхания.
При инфицировании микоплазмой вначале наблюдается интенсивное размножение микоплазмы, без поражения клеток организма. В дальнейшем происходит внедрение микоплазмы в клетку, что ведет к ее деструкции и гибели.
Классификация:
По форме: локализованная, генерализованная, резидуальная;
По течению: острое, подострое, латентное.
Исследования. Выявление микоплазм при бак исследовании мочи, ликвора, гноя, фарингеальной слизи; серологическое исследование (РПГА, РСК, РНГА, определение холодовых агглютининов), метод прямой и непрямой иммунофлюоресценции, иммуноферментного анализа (в качестве скрининга), ПЦР, ДНК-диагностика; рентгенография органов грудной клетки; исследования направленные на выявление поражения внутренних органов.
Клиника. Заболевание начинается остро с повышения температуры тела до 38-39 °С в течение 4-5 дней, повторной рвоты (температурная реакция для недоношенных не характерна). В 50% случаев регистрируются симптомы поражения респираторного тракта: одышка, незначительный непродуктивный кашель, пневмония. Состояние чаще тяжелое или среднетяжелое, выражена общемозговая и менингеальная симптоматика (судороги, потеря сознания, возбуждение, очаговые симптомы в виде гиперкинезов, атаксии, пирамидной недостаточности, пареза глазодвигательных нервов, лицевого нерва и т.д.). Церебральная форма МИ у детей в 45% случаев протекает в виде менингита, в 33% - менингоэнцефалита и энцефалита. Параллельно со снижением температуры тела уменьшается выраженность общемозговых и менингеальных симптомов, которые сохраняются на протяжении 2-3 недель. В ликворе отмечается повышение давления и белка, преимущественно лимфоцитарный плеоцитоз (в 25% случаев – нейтрофильный плеоцитоз). Санация ликвора происходит через 3-5 недели.
У детей, родившихся в удовлетворительном состоянии после непродолжительного «светлого промежутка», появляются дыхательные расстройства, двигательное беспокойство, повышение возбудимости, тремор, постанывание, судороги, угнетение физиологических рефлексов. Одним из первых проявлений МИ у части детей является острая гидроцефалия, развивающаяся на первой неделе жизни.
У недоношенных детей кроме синдрома дыхательных расстройств регистрируются склерема, геморрагический синдром, желтуха, гепато- и спленомегалия.
В 25-50% случаев МИ выявляются пороки развития ЦНС, формирование которых происходит на 3-6-й неделе внутриутробного развития. Возможно формирование окклюзионной гидроцефалии, с гипоплазией височных долей обоих полушарий.
При интранатальном инфицировании в первые дни жизни может развиться менингеальная симптоматика. Возможно латентное течение с манифестацией клинических проявлений менингита или энцефалита спустя несколько недель с развитием в дальнейшем гидроцефалии, абсцессов мозга с задержкой нервно-психического развития ребенка. Возможно развитие полирадикулоневрита, энцефалопатии, поражение глаз, почек, перикарда, плевры, лимфатических узлов, костей (остеомиелит), гепатомегалии, реже спленомегалии.
Внутриутробная микоплазменная пневмония, как правило, протекает с клинической картиной интерстициальной пневмонии при выраженной дыхательной недостаточности, в динамике в легких начинают выслушиваться влажные хрипы. У недоношенных детей в клинической картине с первых минут жизни выявляются респираторные нарушения с признаками дыхательной недостаточности (тахипноэ, поверхностное дыхание, цианоз, усиливающийся при крике, участие вспомогательной мускулатуры в акте дыхания, пенисто-кровянистые выделения изо рта). Аускультативно выслушиваются мелкопузырчатые и крепитирующие хрипы. У большинства детей имеются признаки сердечной недостаточности по правожелудочковому типу, геморрагический синдром. Рентгенологически отмечаются расширения корней легких, эмфизема.
Диагноз МИосновывается на клинико-анамнестических данных, а также на результатах исследования: микробиологического, серологического (РПГА, РСК, РНГА, определение холодовых агглютининов), прямой и непрямой иммунофлюоресценции, иммуноферментного анализа (в качестве скрининга), полимеразной цепной реакции, ДНК-диагностики. Серологические методы диагностики низкоинформативны, так как к микоплазмам не развивается стойкого иммунитета и существует большое количество серотипов возбудителя.
В общем анализе крови у новорожденных при МИ выявляется анемия, тромбоцитопения, моноцитоз, возможен умеренный лейкоцитоз со сдвигом формулы влево (у недоношенных иногда имеется выраженный лейкоцитоз.
Табл. 2. 43. Дифференциальный диагноз врожденного микоплазмоза и хламидиоза
| Признак | Врожденный микоплазмоз | Врожденный хламидиоз |
| РДСН при рождении | Часто | Характерно |
| Поражение ЦНС | Менингоэнцефалит | Не характерно |
| Конъюнктивит | Не характерен | Характерен |
| Этиологическая диагностика | Выделение микоплазм из фарингеальной слизи, мокроты и гноя | Выявление хламидий культуральным методом, ПЦР и др. |
| Серологическая диагностика | Нарастание титра антител в реакции связывания комплемента и реакции непрямой гемагглютинации, и др. | Титр антихламидийных АТ 1: 64 и выше; Наличие специфических АТ IgA и IgM |
| Врожденные пороки развития | Характерных пороков нет (у 15% детей) | Не характерны |
| Поражение органов дыхания | Врожденная пневмония | Упорная интерстициальная пневмония |
| Отеки | Редко | У 50%, выраженные |
| Поражение печени | Конъюгационная затянувшаяся желтуха | Гепатоспленомегалия, конъюгационная желтуха |
| Наличие у матери вялотекущего сальпингоофорита, эндометрита, цервицита | Не характерно | Характерно |
| Эозинофилия, моноцитоз | Не характерно | Характерно |
Лечение. Для профилактики антенатального инфицирования плода беременным назначается антибактериальная терапия (эритромицин, клиндамицин в течение 7 дней) и местное лечение - присыпки шейки матки тетрациклином в комбинации с леворином, обработка влагалища ацидофильной культурой в течение 10 дней.
Для лечения МИ преимущественно используют препараты группы макролидов: эритромицин (50 мг/кг/сутки) или вильпрофен (джозамицин) - 30-40 мг/кг, или азитромицин (5 мг/кг) 1 раз в сутки внутрь, но в 1-й день - 2 раза в сутки в течение 10-14 дней в сочетании с вифероном -1 по 150 000 ЕД ректально 2 раза в день в течение 5 дней с 5-дневными перерывами (2-3 курса). Детям с массой тела до 1500г виферон вводят ректально 3 раза в сутки.
По жизненным показаниям возможно использование препаратов тетрациклинового ряда.
Профилактика: предохранение беременных от инфицирования, своевременное выявление микоплазмоза и проведение специфической терапии. Все беременные женщины с неблагоприятным акушерско-гинекологическим анамнезом подлежат обследованию на микоплазмоз.
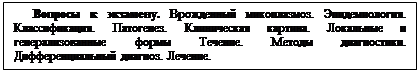
Краснуха (К), перенесенная матерью во время беременности, часто приводит к повреждению эмбриона или плода. Симптомокомплекс, наблюдаемый у новорожденных, объединяется термином «краснушная эмбриопатия» и включает в себя аномалии развития головного мозга, врожденные пороки сердца, дефекты зрения и слуха. Обнаруживаемые изменения бывают настолько тяжелы, что они приводят к инвалидности с детства. Рубеолярная эмбриопатия развивается при инфицировании в I триместре беременности.
Частота и специфичность врожденных пороков развития (ВПР) зависят от времени инфицирования. Впервые 4 нед. гестации ВПР наблюдаются у 90-100% плодов. На 4-8-й нед. — у 50%, на 8-12-я нед. — у 10-15%. Рубеолярная фетопатия возникает при инфицировании плода в II-III триместрах беременности. Она характеризуется отчетливой гипотрофией плода, тромбоцитопенической пурпурой, поражением печени, легких, головного мозга, костей.
Этиология и патогенез. К распространяется воздушно-капельным путем или трансплацентарно. К менее контагиозна, чем корь или ветряная оспа и, следовательно, циркуляция вируса более ограничена. В связи с тем, что во многих странах широко проводится вакцинация против кори, эпидемического паротита и при К К, заболеваемость К резко снизилась. Частота серонегативных молодых женщин составляем приблизительно от 9 до 20-40%. Кроме того, существует проблема субклинически протекающих реинфекций во время беременности у ранее привитых женщин.
Инкубационный период при К составляет 2-3 недели. На 7-9 день развивается выраженная виремия при которой вирусы проникают в лимфоидную ткань, кожу, слизистые оболочки, в головной мозг, а у беременных женщин - в плаценту и, минуя плацентарный барьер - к плоду. Контагиозность больных сохраняется приблизительно в течение 7 дней и примерно 4-х дней после появления сыпи. В сыворотке крови спустя 2-4 дня от начала появления симптомов определяются IgM и IgA, а затем IgG. Очень долго персистирует IgA, a IgG остается в течение всей жизни. К, возникающая во время беременности, в большинстве случаев протекает легко, с появлением неярко выраженной розовой сыпи на коже и с увеличением подчелюстных и шейных лимфоузлов. Реинфекции, как правило, асимптоматичны и могут привести к инфицированию плода, но только в редких случаях дело доходит до эмбриопатий. Вирус может инфицировать эпителий хориона, капиллярный эндотелий кровеносных сосудов плаценты, эндокард плода и через кровоток распространяется во многие органы. Иммунная защита со стороны В-клеток с продукцией вирусоспецифических IgM-антител наступает на 10-13 неделях гестации, IgG - с 16 недели, а IgA-антител - с 30-й недели гестации. К моменту рождения у 98% новорожденных с эмбриопатией могут определяться самостоятельно выработанные IgM-антитела. IgG-антитела являются преимущественно материнскими. Продукция IgM-антител сохраняется после рождения 6-8 месяцев.
Время развития К определяет исход беременности и характер повреждений у плода и новорожденных. В ряде случаев беременность прерывается спонтанным абортом или мертворождениями. При К перед зачатием до 10-го дня после последней менструации не возникает детских инфекций и повреждений. Если инфицирование происходит в первые недели беременности (до 8 недель) в 40% случаев наступает спонтанный аборт, а в остальных 60% случаев - пороки развития плода. При инфицировании на 2-3 месяце беременности риск для плода достигает 30-35%. Возникновение К на 4 месяце создает угрозу для плода в 8-10% случаев.
К, возникающая на поздних стадиях беременности, как правило, не нарушает процессы эмбриогенеза и приводит к фетопатиям в виде увеличения печени и селезенки. В случаях поздней манифестации К наиболее частой патологией является: нарушения слуха, сахарный диабет, судороги и прогрессирующий панэнцефалит. Большая часть этих симптомов появляется у детей, матери которых заболели острой К до 32 недель беременности, в то время как изолированные нарушения слуха связаны с К на 13-17 неделях беременности.
Классификация: 1. « Малый» краснушный синдром (поражение органов зрения, слуха, сердца); 2. «Большой» краснушный синдром (поражение различных органов и систем).
Исследования. Вирусологическое исследование (кал, моча); ИФА; исследования, направленные на выявление поражения внутренних органов.
Клиника. В классическую триаду (триада Грегга) при К входят - пороки развития сердца (ОАП, стеноз легочной артерии, ДМЖП или ДМПП), поражения глаз (глаукома, катаракты, хориоретинит) и нарушения слуха (поражение слухового нерва). Следствием персистирующей К может стать ЗВУР, поражение ЦНС (менингоэнцефалит), нарушение функции печени (гепатит), тромбоцитопения, анемия, интерстициальная пневмония, остеиты, иммунодефицит и дисплазия зубов.
Диагноз. Диагноз ВК основывается на выявлении двух любых основных симптомов (катаракта или врожденная глаукома, врожденный порок сердца, глухота, пигментная ретинопатия) или сочетания одного из указанных основных симптомов и еще одного из дополнительных симптомов (пурпура, спленомегалия, желтуха, микроцефалия, менингоэнцефалит, изменения костей и отставание в умственном развитии).
Лабораторная диагностика.
У новорожденных детей вирус К обнаруживается в кале и моче в течение месяца, в связи, с чем таких детей следует изолировать. Основой диагноза К служит наличие специфических IgM-антител. Обнаружение их до 2-х лет является доказательством перенесенного заболевания. У неинфицированных новорожденных в это время краснушные антитела не обнаруживаются, т.к. прекращается пассивный перенос материнских антител.
Табл. 2.44. Дифференциальный диагноз врожденной краснухи и врожденного микоплазмоза
| Признак | Врожденная краснуха | Врожденный микоплазмоз |
| РДСН при рождении | Не характерен | Часто |
| Поражение ЦНС | Часто (до 82%) Менингоэнцефалит | Менингоэнцефалит |
| Этиологическая диагностика | Выделение вируса краснухи в первом полугодии жизни | Выделение микоплазм из фарингеальной слизи, мокроты и гноя |
| Серологическая диагностика | Обнаружение специфических IgM; Обнаружение специфических IgG во втором полугодии жизни | Нарастание титра антител в реакции связывания комплемента и реакции непрямой гемагглютинации, и др. |
| Врожденные пороки развития | Характерны пороки: глаукома, микрофтальмия, ВПС, пороки ЖКТ | Характерных пороков нет |
| Поражение зрения | Катаракты | Не характерна |
| Поражение слуха | Глухота | Не характерно |
| Поражение печени | Гепатит, повышение прямого билирубина | Конъюгационная затянувшаяся желтуха |
| Сахарный диабет | У 20% детей | Не характерно |
Лечение врожденной К не разработано. Рекомендуют использование виферона 1, интрона, роферона.
Профилактика. Важнейшим средством предупреждения возникновения краснушной эмбриофетопатии являются прививки, которые создают у большинства прививаемых детей устойчивый иммунитет. С течением времени у привитых снижается титр специфических антител и возрастает угроза инфицирования женщин репродуктивного возраста. Поэтому вторым обязательным условием профилактики является введение в существующую схему обследования беременных женщин лабораторной диагностики на К. Существующая практика прерывания беременности при контакте беременной женщины с К не может быть правильной, т.к. не учитывает уровень у нее противокраснушного иммунитета. Согласно современным представлениям в этих ситуациях должна быть определена направленность гуморального иммунного ответа к антигенам вируса К. С этой целью используют реакции бластной трансформации лимфоцитов (РБТЛ), обнаружение в крови антител к вирусу К, относящихся к классу IgM, что свидетельствует о краснушной инфекции.
Появление клинически выраженной краснухи и IgM-антител свидетельствует о свежеперенесенной К и служит показанием для прерывания беременности (I-II триместр).
За беременными женщинами, имевшими контакт с К, но без клинических симптомов заболевания и отсутствием противокраснушных антител, рекомендуется вести диспансерное наблюдение. В программу обследования включается иммунологическое и ультразвуковое исследование. При отсутствии IgM-антител делается вывод о возможности сохранения беременности. Ультразвуковой контроль за состоянием плода проводится на 16-22 неделях гестации, а повторно - на 25-28 неделях. Серонегативные или беременные с неизвестным иммунологическим статусом после контакта с К в первые 16 недель беременности тотчас должны получить краснушный иммуноглобулин (0,3 мл/кг, т.e. в среднем 15 мл). Если спустя 4-6недель титр IgM повышается, рекомендуется прервать беременность из-за высокого риска краснушной эмбриопатии.
 |
Глава IX. Неинфекционные заболевания системы дыхания
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ НОВОРОЖДЕННЫХ (РДСН) – тяжелое расстройство дыхания у недоношенных новорожденных, обусловленное незрелостью и первичным дефицитом сурфактанта. Синонимы: болезнь гиалиновых мембран, респираторный дистресс-синдром.
Эпидемиология. РДСН – наиболее частая причина возникновения дыхательной недостаточности в раннем неонатальном периоде. РДСН выявляется тем чаще, чем меньше гестационный возраст и масса тела ребенка при рождении. У детей, родившихся ранее 30 недель гестации и не получавших пренатальной профилактики бетаметазоном или дексаметазоном, его частота составляет около 65%, при проведении профилактики – 35%; у детей, родившихся при сроке гестации 30-34 недели, без профилактики - 25%, при проведении профилактики – 10%; у детей, родившихся при сроке гестации больше 34 недель, частота развития РДСН не зависит от пренатальной профилактики и составляет менее 5%.
Предрасполагающие факторы развития РДСН:
- недоношенность;
- кесарево сечение до начала родовой деятельности;
- тяжелая перинатальная асфиксия;
- сахарный диабет у матери (при невынашивании в 4-6 раз чаще, чем у детей аналогичного гестационного возрасте от матерей без диабета);
- преждевременная отслойка плаценты;
- мужской пол (у мальчиков СДР встречается в 2 раза чаще, чем у девочек);
- второй ребенок из двойни;
- тяжелая форма гемолитической болезни плода и новорожденного;
- гипотермия;
- развитие РДСН у родных братьев и сестер (в анамнезе).
К факторам, уменьшающим риск развития РДСН, относятся: гипертензионные состояния беременных, серповидно-клеточная анемия у матери, наркотическая зависимость матери, задержка внутриутробного развития и длительный (более 24 часов) безводный промежуток.
Существенно снижает риск развития РДСН назначение беременной женщине глюкокортикоидов за 2-7 суток до предполагаемых родов (в период с 23-й по 35-ю неделю гестации).
Этиология. Наиболее частыми причинами дыхательных расстройств у новорождённых являются:
1. обструкция дыхательных путей – назальная или назофарингеальная атрезия хоан, отёк носа, макроглоссия, микрогнатия, перепонка гортани, подгортанный стеноз, опухоли глотки и гортани (в том числе гемангиома), паралич связочного аппарата, ларингомаляция, трахеомаляция, стеноз трахеи, сужение бронхов;
2. поражение паренхимы лёгких – болезнь гиалиновых мембран, ателектазы лёгких, синдром задержки резорбции фетальной жидкости, мекониальная аспирация, другие аспирационные синдромы, синдром утечки воздуха (пневмоторакс, пневмомедиастинум, пневмоперикард, интерстициальная эмфизема), внутриутробные пневмонии, легочное кровотечение (отёчно-геморрагический синдром), синдром Вильсона-Микити хроническая легочная болезнь недоношенных;
3. пороки развития – агенезия или гипоплазия легких, киста лёгкого, врождённая долевая эмфизема, опухоли грудной полости, трахеоэзофагальный свищ, диафрагмальные грыжи;
4. внелегочные причины – асфиксия в родах, синдром персистирующих фетальных коммуникаций (персистирующая легочная гипертензия и др.), врождённые пороки сердца, шок (острая сердечно-сосудистая недостаточность), врождённые пороки развития ЦНС, травматические повреждения ЦНС, нейромышечные заболевания (миотоническая дистрофия, миастения), септицемия, анемия, полицитемия, побочное действие лекарственных препаратов (барбитуратов, наркотических анальгетиков и др.), гипогликемия, метаболический ацидоз, метаболический алкалоз, гипертермия, гипотермия.
Основными причинами развития РДСН являются: 1) нарушение синтеза и экскреции сурфактанта альвеолоцитами II типа, связанное с незрелостью легочной ткани; 2) врожденный дефект структуры сурфактанта; 3) повышенное разрушение сурфактанта на фоне тяжелой перинатальной гипоксии.
Сурфактант – группа поверхностно-активных веществ липопротеидной природы, препятствующих спадению альвеол на выдохе, способствующих мукоцилиарному клиренсу и участвующих в регуляции микроциркуляции в легких и проницаемости стенок альвеол.
Особенно интенсивный выброс сурфактанта на поверхность альвеол происходит в момент родов, что способствует первичному расправлению легких.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 530; Нарушение авторских прав?; Мы поможем в написании вашей работы!