
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Для животных
|
|
|
|
Определение углекислоты в воздухе помещений
По количеству углекислого газа судят о чистоте воздуха в помещениях для сельскохозяйственных животных, а также этот показатель учитывают при расчетах вентиляции и теплового баланса.
Принцип определения основан на способности щелочей энергично поглощать из воздуха углекислоту:
Ва(ОН)2: 8Н2О+СО2 = ВаСО3+9Н2О.
Чаще всего для определения углекислоты применяют метод Субботина— Нагорского. Этот метод наиболее точен, но громоздок. Для удобства мы предлагаем упрощенный метод.
Реактивы: 1) эмпирический раствор едкого бария, 1 мл которого способен связать 1 мг углекислоты;
2) раствор щавелевой кислоты, 1 мл которого эквивалентен 1 мл эмпирического раствора едкого бария. Навески на 1 л дистиллированной воды рассчитывают так:
а) Ва(ОН)2-8Н2O имеет молекулярный вес 315,5,
б) CO2 имеет молекулярный вес 44.
Чтобы получить раствор едкого бария вышеуказанной концентрации, необходимо взять навеску 315,5 / 44 = 7,17 г на 1 л дистиллированной воды, свободной от СО2.
Аналогично рассчитывают навеску для приготовления эквивалентного раствора, щавелевой кислоты:
молекулярный вес С2Н2О4 - 2Н2О = 126; 126/44 = 2,8636 г
на 1 л дистиллированной воды, освобожденной от СО2;
3) 1%-ный спиртовой раствор фенолфталеина.
Аппаратура: круглая, плоскодонная, калиброванная до края пробки колба емкостью около 1 л с пригнанной к ней пробкой; шары Ричардсона; штатив Бунзена с лапками; бюретка для раствора щавелевой кислоты; бюретка с 'хлоркальциевой трубкой для раствора едкого бария; флакон с раствором фенолфталеина; пробирка с пробкой, в которой отмечен объем в 10 мл для эмпирического раствора едкого бария.
Техника забора пробы воздуха. Колбу заполняют исследуемым воздухом путем накачивания шарами Ричардсона в течение 1,5 минуты. Затем в колбу вливают 10 мл баритового раствора и закрывают ее пробкой до калибровочной черты. Записывают номер колбы, температуру воздуха в исследуемой точке и барометрическое давление. После этого взбалтывают баритовый раствор в колбе с исследуемым воздухом в течение 10 минут.
Техника титрования. Предварительно отмечают в бюретке уровень раствора щавелевой кислоты по нижнему мениску с точностью до 0,05 мл. Затем в колбу добавляют две капли раствора фенолфталеина. Раствор едкого бария, не связавшийся с углекислотой во взятой пробе воздуха, оттитровывают раствором щавелевой кислоты до полного обесцвечивания. При титровании колбу держат за край горлышка, закрывая просвет горлышка резиновым колпачком с небольшим отверстием посредине. Капли раствора щавелевой кислоты должны падать только на поверхность раствора. Количество миллилитров израсходованного на титрование раствора щавелевой кислоты записывают с точностью до 0,05 мл.
Пример расчета. 1, Вычитают из 10 мл раствора едкого бария количество миллилитров, затраченного на титрование раствора щавелевой кислоты. Полученное количество миллилитров будет соответствовать количеству миллиграммов углекислоты в исследуемом воздухе.
2. Миллиграммы найденной углекислоты переводят в миллилитры умножением на 0,509 (1 мг СО2 при нормальных условиях занимает объем, равный 0,509 мл).
Таблица 3
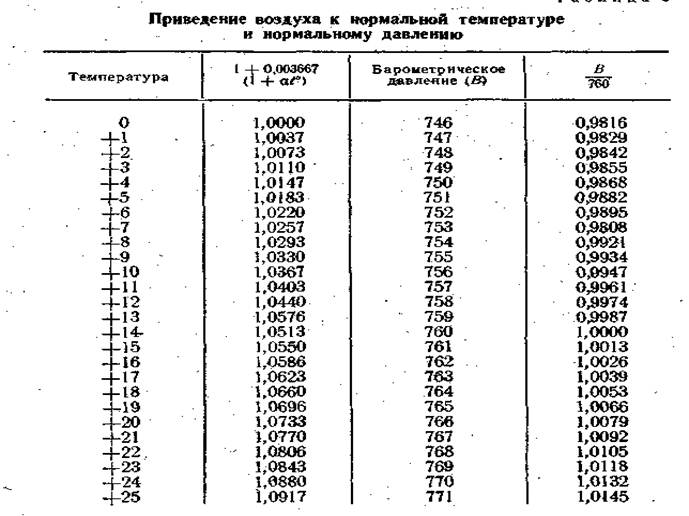
3. Вычитают из объема колбы 10 мл (количество влитого раствора едкого бария) и приводят объем взятой в колбу пробы воздуха к 0° и 760 мм давления по формуле:
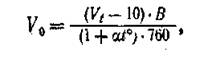

|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 1044; Нарушение авторских прав?; Мы поможем в написании вашей работы!