
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хемічний потенціал
|
|
|
|
8.2.1.Хемічний потенціал при р,Т=const
Реальні хемічні і фізико-хемічні процеси протікають при зміні кількости компонентів (n i =var). Так, для гомогенної реакції
A→B
кількість компонентів вихідної речовини nА зменшується, а продуктів реакції nВ зростає. Теж саме для фазового перетворення
Ф1→Ф2
кількість фази 1 (n1) зменшується, а фази 2 (n2) зростає.
1. Так як ізобарно-ізотермний потенціал (потенціал Ґіббса) G для системи із змінною кількістю компонентів залежить від тиску, температури і кількости компонентів (нехай компонентів N):
G=G(p, T, n1, n2, …, n i, …, nN),
то його повний диференціал dG дорівнює:
 ;(8.47)
;(8.47)
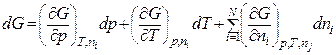 ,
,  (8.48)
(8.48)
де n i – постійна кількість молей і-го компоненту;
nj – постійна кількість молей всіх інших компонентів (окрім одного і-го).
1,2,…, і,…, j,,N – номер компоненту;
n1, n2, …ni,…,nj,…, nN – кількість молей 1,2,…, і,…, j,,N-го компоненту.
2. Означимо хемічний  потенціал і-го компоненту при р,Т=const так:
потенціал і-го компоненту при р,Т=const так:
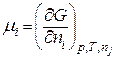 , (8.49)
, (8.49)
тоді (8.48) запишемо так:
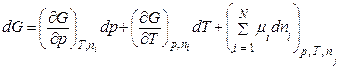 . (8.50)
. (8.50)
3. При р,Т=const рівняння (8.50) набуде вигляду:

 . (8.51)
. (8.51)
Після інтегрування (8.51), отримаємо вираз для зміни потенціалу Ґіббса:
 ; (8.52)
; (8.52)
звідки
 , (8.53)
, (8.53)
де ∆n і – зміна кількости молей і-го компоненту.
4. Якщо ∆n і =1 моль, то
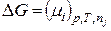 . (8.54)
. (8.54)
Звідки витікає фізичний смисл хемічного потенціалу при р,Т=const: він чисельно дорівнює зміні термодинамічного потенціалу Ґіббса G при додаванні 1 моля і-го компоненту до безкінечної кількости системи, яка знаходиться при р,Т=const.
5. Хемічний потенціал чистої речовини при р,Т=const дорівнює:
μ=G, (8.55)
тобто потенціалу Ґіббса 1 моля чистої речовини.
При додаванні 1 моля чистої речовини потенціал Ґіббса зміниться на величину G 1 моля.
6. При р,Т=const самочинний процес відбувається у напрямку зменшення термодинамічного потенціалу Ґіббса:
∆G≤0. (8.56)
Звідки, враховуючи рівняння (8.51), хемічний потенціал при р,Т=const буде змінюватися так:
 . (8.57)
. (8.57)
7. Умови термодинамічної рівноваги при р,Т=const визначаються так:
dG=0. (8.58)
Звідки хемічний потенціал при термодинамічній рівновазі при р,Т=const буде дорівнювати:
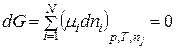 . (8.59)
. (8.59)
8. При цьому в процесі р,Т=const корисна робота дорівнює:
 . (8.60)
. (8.60)
8.2.2.Хемічний потенціал при V,Т=const
1. Так як ізохорно-ізотермний потенціал (потенціал Гельмгольца) F для системи із змінною кількістю молей компонентів залежить від об’єму, температури і кількости компонентів (нехай компонентів N):
F=F(V, T, n1, n2, …, n i, …, nN), (8.61)
то його повний диференціал dG дорівнює:
 .
.  (8.62)
(8.62)
2. Означимо хемічний  потенціал і-го компоненту при V,Т=const так:
потенціал і-го компоненту при V,Т=const так:
 . (8.63)
. (8.63)
Тоді (8.62) запишемо так:
 . (8.64)
. (8.64)
3. При V,Т=const рівняння (8.64) набуде вигляду:

 . (8.65)
. (8.65)
Після інтегрування (8.65), отримаємо вираз для зміни потенціалу Гельмгольца:
 ; (8.66)
; (8.66)
звідки
 . (8.67)
. (8.67)
4. Якщо ∆n і =1 моль, то
 . (8.68)
. (8.68)
Звідки витікає фізичний смисл хемічного потенціалу при V,Т=const: він чисельно дорівнює зміні термодинамічного потенціалу Гельмгольца F при додаванні 1 моля і-го компоненту до безкінечної кількости системи, яка знаходиться при V,Т=const.
5. Хемічний потенціал чистої речовини при V,Т=const дорівнює:
μ= F, (8.69)
тобто при додаванні 1 моля чистої речовини потенціал Гельмгольца змінюється на величину F 1 моля.
6. При V,Т=const самочинний процес відбувається у напрямку зменшення термодинамічного потенціалу Гельмгольца:
∆ F ≤0. (8.70)
Звідки, враховуючи рівняння (8.65), хемічний потенціал при V,Т=const буде змінюватися так:
 . (8.71)
. (8.71)
7. Умови термодинамічної рівноваги при V,Т=const визначаються так:
dF =0. (8.72)
Звідки хемічний потенціал при термодинамічній рівновазі при V,Т=const буде дорівнювати:
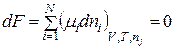 . (8.73)
. (8.73)
8. При цьому в процесі V,Т=const корисна робота дорівнює:
 . (8.74)
. (8.74)
8.2.3.Хемічний потенціал при V,S=const
1. Так як внутрішня енергія U як термодинамічний потенціал для системи із змінною кількістю молей компонентів залежить від об’єму, ентропії і кількости компонентів:
U = U(V, S, n1, n2, …, n i, …, nN), (8.75)
то його повний диференціал dU дорівнює:
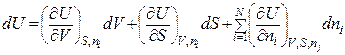 .
.  (8.76)
(8.76)
2. Означимо хемічний  потенціал і-го компонента при V, S=const так:
потенціал і-го компонента при V, S=const так:
 . (8.77)
. (8.77)
Тоді (8.76) запишемо так:
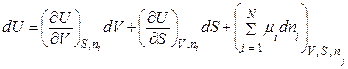 . (8.78)
. (8.78)
3. При V, S=const рівняння (8.78) набуде вигляду:

 . (8.79)
. (8.79)
Після інтеґрування (8.79), отримаємо вираз для зміни потенціалу U:
 ; (8.80)
; (8.80)
звідки
 . (8.81)
. (8.81)
4. Якщо ∆n і =1 моль, то
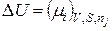 . (8.82)
. (8.82)
Звідки витікає фізичний смисл хемічного потенціалу при V, S =const: він чисельно дорівнює зміні термодинамічного потенціалу U при додаванні 1 моля і-го компоненту до безкінечної кількости системи, яка знаходиться при V,S =const.
5. Хемічний потенціал чистої речовини при V,S=const дорівнює:
μ=U, (8.83)
тобто при додаванні 1 моля чистої речовини потенціал U змінюється на величину U 1 моля.
6. При V, S=const самочинний процес відбувається у напрямку зменшення термодинамічного потенціалу U:
∆U ≤0. (8.84)
Звідки, враховуючи рівняння (8.79), хемічний потенціал при V,S=const буде змінюватися так:
 . (8.85)
. (8.85)
7. Умови термодинамічної рівноваги при V, S=const визначаються так:
dU =0. (8.86)
Звідки хемічний потенціал при термодинамічній рівновазі при V,S=const буде дорівнювати:
 . (8.87)
. (8.87)
8.2.4.Хемічний потенціал при р,S=const
1. Так як ентальпія Н як термодинамічний потенціал для системи із змінною кількістю молей компонентів залежить від тиску, ентропії і кількости молей компонентів:
Н = Н(р, S, n1, n2, …, n i, …, nN), (8.88)
то його повний диференціал dН дорівнює:
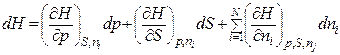 .
.  (8.89)
(8.89)
2. Означимо хемічний  потенціал і-го компоненту при р, S=const так:
потенціал і-го компоненту при р, S=const так:
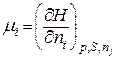 . (8.90)
. (8.90)
Тоді (8.89) запишемо так:
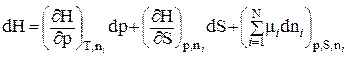 . (8.91)
. (8.91)
3. При р, S=const рівняння (8.91) набуде вигляду:

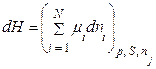 . (8.92)
. (8.92)
Після інтеґрування (8.92), отримаємо вираз для зміни потенціалу Н:
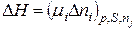 ; (8.93)
; (8.93)
звідки
 . (8.94)
. (8.94)
4. Якщо ∆n і =1 моль, то
 . (8.95)
. (8.95)
Звідки витікає фізичний смисл хемічного потенціалу при р, S =const: він чисельно дорівнює зміні термодинамічного потенціалу Н при додаванні 1 моля і-го компоненту до безкінечної кількости системи, яка знаходиться при р,S =const.
5. Хемічний потенціал чистої речовини при р, S=const дорівнює:
μ=Н, (8.96)
тобто при додаванні 1 моля чистої речовини потенціал Н змінюється на величину Н 1 моля.
6. При р, S=const самочинний процес відбувається у напрямку зменшення термодинамічного потенціалу Н:
∆Н ≤0. (8.97)
Звідки, враховуючи рівняння (8.92), хемічний потенціал при р,S=const буде змінюватися так:
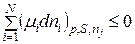 . (8.98)
. (8.98)
7. Умови термодинамічної рівноваги при р, S=const визначаються так:
dН =0.
Звідки хемічний потенціал при термодинамічній рівновазі при р,S=const буде дорівнювати:
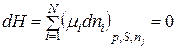 . (8.99)
. (8.99)
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 376; Нарушение авторских прав?; Мы поможем в написании вашей работы!