
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рівняння рівноваги для суміші ідеальних ґазів і константа рівноваги
|
|
|
|
1. Нехай хемічна реакія (9.23) протікає в суміші ідеальних ґазів A, B, L, E з початковими нерівноваговими парціальними тисками 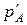 ,
, 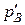 ,
, 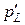 ,
, 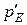 , які відповідають довільно заданому складу.
, які відповідають довільно заданому складу.
Для хемічного потенціалу кожного компоненту можна записати:
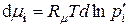 (9.26)
(9.26)
і після інтеґрування:
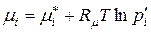 , (9.27)
, (9.27)
де  – стала інтеґрування, яка пов’язана із стандартним хемічним потенціалом
– стала інтеґрування, яка пов’язана із стандартним хемічним потенціалом 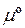 співвідношенням:
співвідношенням:
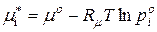 , (9.28)
, (9.28)
де 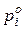 =1 атм=0,101325 МПа;
=1 атм=0,101325 МПа;
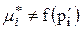 , але
, але 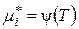 .
.
Підставимо (9.26) у (9.25), отримаємо
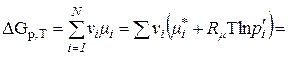
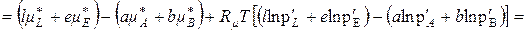
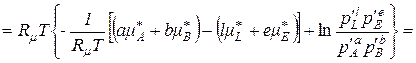

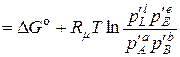 , (9.29)
, (9.29)
де 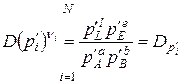 ; (9.30)
; (9.30)
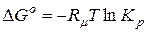 ; (9.31)
; (9.31)
 ; 9.32)
; 9.32)
D – знак добутку.
Рівняння
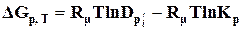 (9.33)
(9.33)
носить назву рівняння ізотерми хемічної реакції вант-Гоффа, де 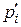 – парціальні тиски компонентів, що відносяться до довільно заданого складу реакційної системи;
– парціальні тиски компонентів, що відносяться до довільно заданого складу реакційної системи;
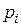 – те ж саме для умов рівноваги.
– те ж саме для умов рівноваги.
Це рівняння правдиве при умові сталости складу ґазової суміші.
2. Якщо хемічна реакція досягла стану рівноваги, то
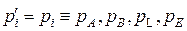 – рівновагові парціальні тиски компонентів, а Кр – константа рівноваги хемічної реакції.
– рівновагові парціальні тиски компонентів, а Кр – константа рівноваги хемічної реакції.
Для рівновагового стану потенціал Ґіббса хемічної реакції (9.23) дорівнює:
 . (9.34)
. (9.34)
Тоді з (9.25) при 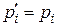 :
:
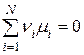 , (9.35)
, (9.35)
а з (9.29-9.31)
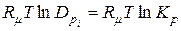 ,
, 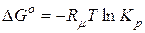 ;
;
а константа рівноваги:
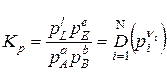 . (9.36)
. (9.36)
Як видно з (9.32) константа рівноваги хемічної реакції не залежить від загального тиску суміші і парціального тиску ґазів, що складають суміш ґазів, але залежить від температури.
3. Зв’язок між рівноваговими концентраціями або парціальними тисками речовин, що беруть участь в хемічній реакції, виражається законом діяння мас К.М.Ґульдберґа (Ґульберґа) (Guldberg) і П.Воґе (Вааґе) (Waage) (1867 р.).
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 394; Нарушение авторских прав?; Мы поможем в написании вашей работы!