
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И простых эфиров
|
|
|
|
Основные химические свойства спиртов, фенолов
Пример решения задачи 23
Решение
1. Располагаем пентан-2,3-диол; метанол; 2,4-дибромфенол; 2-метилфенол в порядке возрастания их кислотных свойств.
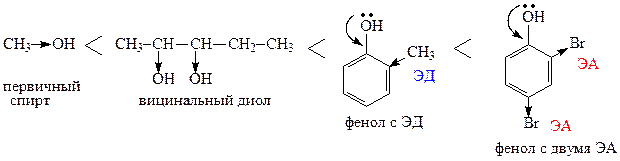
2. Приводим уравнения реакций, которые иллюстрируют кислотные свойства данных веществ:
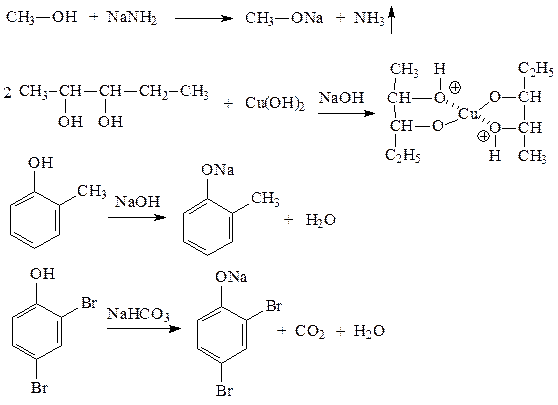
Для наиболее сильного основанияприводим уравнение реакции образования оксониевой соли с H2SO4.
Самым сильным основанием в этом ряду будет самая слабая кислота - метанол.
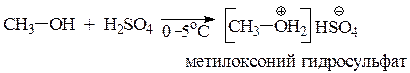
Для решения данного задания необходимо изучить основные химические свойства спиртов, фенолов и простых эфиров.
1. Реакции замещения:
а) реакции замещения ОН-группы спиртов на галоген. Гидроксильную группу в спиртах можно заместить на галоген действием концентрированных бромо- или иодоводородных кислот, реагента Лукаса (НCl + ZnCl2), галогенидов фосфора и тионилхлорида:
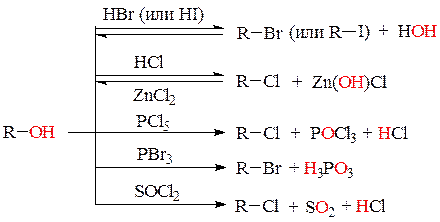
Фенолы (за исключением нитрофенолов) не вступают в реакции замещения ОН-группы.
б) реакции с неорганическими кислородсодержащими кислотами являются общим способом получения сложных эфиров неорганических кислот. Многоосновные кислоты дают как кислые, так и средние эфиры:

Фенолы, в отличие от спиртов, не образуют сложные эфиры минеральных кислот. В этих условиях в фенолах протекают реакции замещения Н-атома в бензольном кольце (см. ниже реакции подпункта «е»)
в) реакции дегидратации спиртов протекают под действием сильных минеральных кислот (H2SO4; H3PO4) или Al2O3 при нагревании. В зависимости от температуры и строения спирта возможны два направления реакции: межмолекулярная дегидратация (с образованием простого эфира) и внутримолекулярная дегидратация (с образованием алкена). Чем выше температура реакции, тем больше вклад реакции элиминирования (отщепления). Третичные спирты отщепляют воду с образованием алкенов в присутствии менее концентрированных кислот при более низких температурах. Такие спирты практически не образуют простые эфиры.
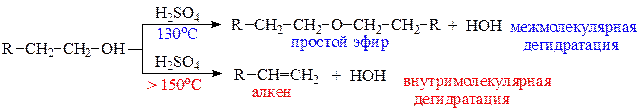
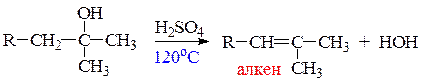
Фенолы, в отличие от спиртов, не вступают в реакции дегидратации.
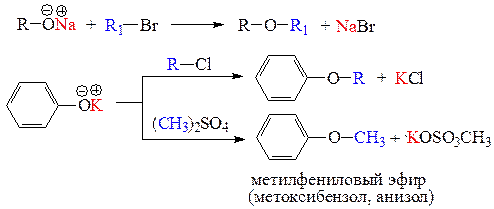
г) реакции О-алкилирования - замещение подвижного Н-атома или металла на алкильный (или арильный) заместитель. Спирты и фенолы алкилируются в виде солей активных металлов (алкоголятов и фенолятов) с образованием простых эфиров - реакция Вильямсона.
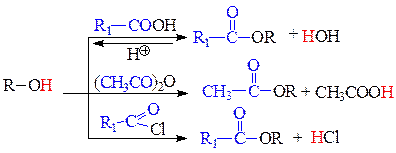
д) реакции О-ацилирования - замещение подвижного Н-атома или металла на ацильный заместитель. В качестве ацилирующих средств используются карбоновые кислоты, их ангидриды и галогенангидриды. В результате реакций ацилирования образуются сложные эфиры. Спирты ацилируются всеми перечисленными ацилирующими средствами. Фенолы ацилируются только в виде фенолятов и только сильными ацилирующими средствами: ангидридами и галогенангидридами кислот.
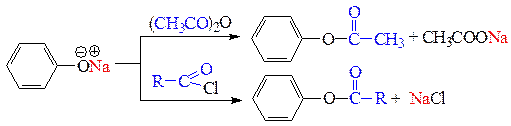
е) реакции фенолов по бензольному кольцу протекают легко, чаще всего не требуют катализаторов. Реакция фенола с бромной водой является качественной - происходит обесцвечивание бромной воды и выпадает светлый осадок 2,4,6-трибромфенола.

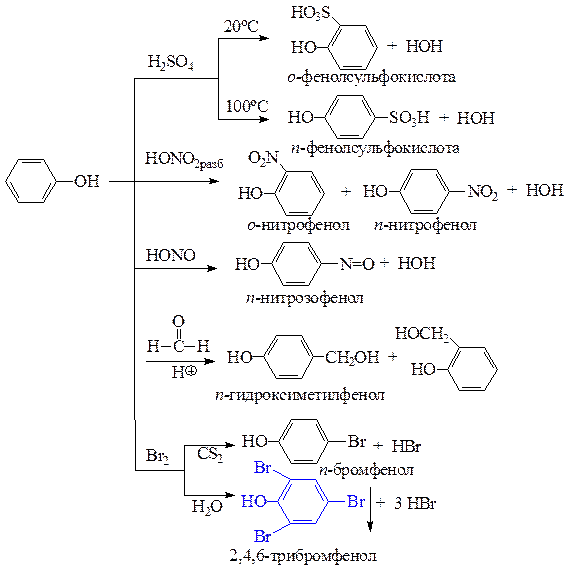

2. Реакции окисления:
а) жесткое окисление спиртов приводит к образованию альдегидов, кетонов и карбоновых кислот. Первичные спирты окисляются в соответствующие альдегиды, а затем в кислоты. Вторичные спирты при окислении образуют кетоны. Третичные спирты довольно устойчивы к действию окислителей, однако в кислотных растворах окислителей может происходить разрыв С-С связей возле гидроксильной группы с образованием смеси кислот и кетонов с меньшим числом С-атомов.
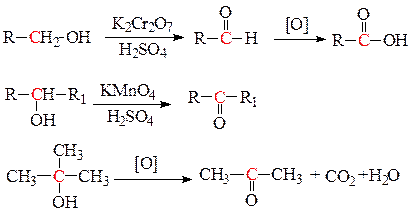
Под действием высоких температур в присутствии катализаторов - тонкодисперсной меди, серебра или оксида цинка - спирты дегидрируются до соответствующих альдегидов (первичные спирты) или кетонов (вторичные спирты).

б) окисление простых алифатических эфиров происходит на свету под действием кислорода воздуха. Окислению подвергается α-углеродный атом, образуются взрывоопасные неустойчивые гидропероксиды и пероксиды.
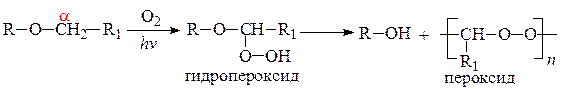
в) окисление фенолов жесткими окислителями сопровождается разрушением бензольного кольца с образованием трудноразделимой смеси индивидуальных соединений. При окислении броматами можно получить определенные продукты:
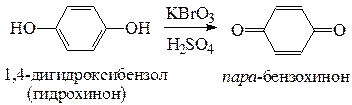
3. Реакции расщепления простой эфирной связи:
а) расщепление простых эфиров концентрированной иодоводороной кислотой происходит при нагревании и приводит к образованию спирта и иодалкана. Если эфир несимметричный, то могут образовываться два различных спирта и два иодалкана. При расщеплении алкилариловых эфиров всегда образуется фенол и иодалкан:
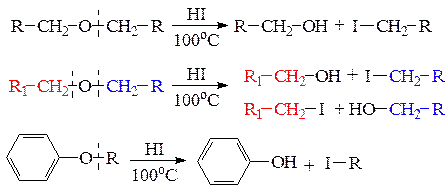
б) расщепление простой эфирной связи металлическим натрием или литием происходит при нагревании с образованием алкоголятов или фенолятов и металлорганических соединений.
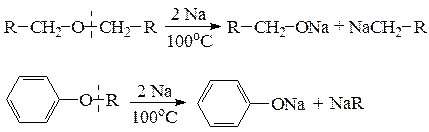
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 1634; Нарушение авторских прав?; Мы поможем в написании вашей работы!