
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Контроль точности анализа
|
|
|
|
Соблюдайте осторожность при работе с растворами щелочи и кислоты!
Определение железа
Оборудование и реактивы
Бумага индикаторная универсальная, контрольная шкала образцов окраски, мерная склянка с меткой «10 мл» с пробкой, пипетка-капельница, шприц-дозатор (медицинский) на 2 мл с соединительной трубкой.
Вода дистиллированная, раствор орто-фенантролина (0,1 %), раствор буферный ацетатный, раствор гидроксида натрия (10 %), раствор соляной кислоты (1:10), раствор солянокислого гидроксиламина (10 %).
Контрольная шкала для определения железа (0; 0,1; 0,3; 0,7; 1,5 мг/л) из состава тест-комплекта либо приготовленная самостоятельно.
О приготовлении растворов см. приложение 3.
1. Налейте в склянку анализируемую воду до метки «10 мл», предварительно ополоснув ее 2-3 раза той же водой. Используя универсальную индикаторную бумагу, определите рН среды. С помощью пипетки-капельницы, в зависимости от найденного рН, добавляйте растворы гидроксида натрия либо соляной кислоты, доведите рН пробы до рН 4-5.
2. В склянку пипеткой-капельницей добавьте 4-5 капель раствора солянокислого гидроксиламина (около 0,2 мл). Склянку закройте пробкой и встряхните для перемешивания раствора.
3. Далее шприцем с наконечником-пипеткой поочередно добавьте
1,0 мл ацетатного буферного раствора и 0,5 мл раствора орто-фенантролина (перед прибавлением каждого раствора пипетку промойте, заполняя и полностью сливая дистиллированную воду). После каждого прибавления склянку закрывайте пробкой и встряхивайте для перемешивания раствора.
4. Раствор в склянке оставьте не менее чем на 15-20 мин. для полного развития окраски.
5. Проведите визуальное колориметрирование пробы. Для этого склянку с пробой поместите на белое поле контрольной шкалы и, освещая склянку рассеянным белым светом достаточной интенсивности, определите ближайшее по окраске поле контрольной шкалы и соответствующее ему значение концентрации железа общего в мг/л.
При получении результата анализа учтите разбавление пробы чистой водой, введя поправочный коэффициент (например, при разбавлении пробы в 4 раза, т.е. при отборе 5 мл анализируемой воды, полученное по шкале значение концентрации умножьте на 4).
Контроль точности при определении общего железа может быть выполнен путем тестирования специально приготовленного раствора соли Мора (по катиону Fе2+) в кислой среде при концентрациях, равных значениям, приведенным для образцов на контрольной шкале.
Может быть использован также поверенный (образцовый) иономер с ион-активным электродом на Fе2+ (потенциометрический метод).
Сумма тяжелых металлов. Тяжелые металлы относятся к приоритетным загрязняющим веществам, наблюдения за которыми обязательны во всех средах. На сегодняшний день к тяжелым металлам относят более 40 элементов периодической системы Д.И. Менделеева с атомной массой свыше 50 атомных единиц (V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo, Cd, Sn, Hg, Pb и др.). При этом немаловажную роль играют следующие условия: их высокая токсичность для живых организмов в относительно низких концентрациях, а также способность к биоаккумуляции и биомагнификации. Практически все металлы, попадающие под это определение (за исключением свинца, ртути, кадмия и висмута, биологическая роль которых в настоящий момент не ясна), активно участвуют в биологических процессах, входят в состав многих ферментов. По классификации Н. Реймерса, тяжелыми следует считать металлы с плотностью более 8 г/см3.
Формально определению тяжелые металлы соответствует большое количество элементов. Однако, по мнению исследователей, занятых практической деятельностью, связанной с организацией наблюдений за состоянием и загрязнением окружающей среды, соединения этих элементов далеко не равнозначны как загрязняющие вещества. Поэтому во многих работах происходит сужение рамок группы тяжелых металлов в соответствии с критериями приоритетности, обусловленными направлением и спецификой работ. Так, в ставших уже классическими работах Ю.А. Израэля в перечне химических веществ, подлежащих определению в природных средах на фоновых станциях в биосферных заповедниках, в разделе «тяжелые металлы» поименованы Pb, Hg, Cd, As. С другой стороны, согласно решению Целевой группы по выбросам тяжелых металлов, работающей под эгидой Европейской Экономической Комиссии ООН и занимающейся сбором и анализом информации о выбросах загрязняющих веществ в Европейских странах, только Zn, As, Se, Sb были отнесены к тяжелым металлам. По определению Н. Реймерса, отдельно от тяжелых металлов стоят благородные и редкие металлы, соответственно, остаются только Pb, Cu, Zn, Ni, Cd, Co, Sn, Sb, Bi, Hg. В прикладных работах к числу тяжелых металлов чаще всего добавляют Pt, Ag, W, Fe, Au, Mn.
Ионы металлов являются непременными компонентами природных водоемов. В зависимости от условий среды (рН, окислительно-восстановительного потенциала, наличия лигандов) они существуют в разных степенях окисления и входят в состав разнообразных неорганических и металлоорганических соединений, которые могут быть истинно растворенными, коллоидно-дисперсными или входить в состав минеральных и органических взвесей.
Истинно растворенные формы металлов в свою очередь, весьма разнообразны, что связано с процессами гидролиза, гидролитической полимеризации (образованием полиядерных гидрокомплексов) и комплексообразования с различными лигандами. Соответственно, как каталитические свойства металлов, так и доступность для водных микроорганизмов зависят от форм существования их в водной экосистеме.
Многие металлы образуют довольно прочные комплексы с органическими соединениями; эти комплексы являются одной из важнейших форм миграции элементов в природных водах. Большинство органических комплексов образуются по хелатному механизму и являются устойчивыми. Комплексы, образуемые почвенными кислотами с солями железа, алюминия, титана, урана, ванадия, меди, молибдена и других тяжелых металлов, относительно хорошо растворимы в условиях нейтральной, слабокислой и слабощелочной сред. Поэтому металлоорганические комплексы способны мигрировать в природных водах на весьма значительные расстояния. Особенно важно это для маломинерализованных и, в первую очередь, поверхностных вод, в которых образование других комплексов невозможно.
Для понимания факторов, которые влияют на концентрацию металла в природных водах, их химическую реакционную способность, биологическую доступность и токсичность, необходимо знать не только валовое содержание, но и долю свободных и связанных форм металла.
Переход металлов в водной среде в металлокомплексную форму имеет три следствия:
· может происходить увеличение суммарной концентрации ионов металла за счет перехода его в раствор из донных отложений;
· мембранная проницаемость комплексных ионов может существенно отличаться от проницаемости гидратированных ионов;
· токсичность металла в результате комплексообразования может сильно измениться.
Так, хелатные формы меди, кадмия, ртути менее токсичны, нежели свободные ионы. Для понимания факторов, которые регулируют концентрацию металла в природных водах, их химическую реакционную способность, биологическую доступность и токсичность, необходимо знать не только валовое содержание, но и долю связанных и свободных форм.
Источниками загрязнения вод тяжелыми металлами служат сточные воды гальванических цехов предприятий горнодобывающей промышленности, черной и цветной металлургии, машиностроительных заводов. Тяжелые металлы входят в состав удобрений и пестицидов и могут попадать в водоемы вместе со стоком с сельскохозяйственных угодий.
Повышение концентрации тяжелых металлов в природных водах часто связано с другими видами загрязнения, например, с закислением. Выпадение кислотных осадков способствует снижению рН и переходу металлов из сорбированного (на минеральных и органических веществах) состояния в свободное.
Тяжелые металлы, попадая в воду, могут существовать в виде растворимых токсичных солей и комплексных соединений (иногда очень устойчивых), коллоидных частиц, осадков (свободных металлов, оксидов, гидроксидов и др.). Тяжелые металлы в водоеме вызывают целый ряд негативных последствий: попадая в пищевые цепи и нарушая элементный состав биологических тканей, они оказывают тем самым прямое или косвенное токсическое воздействие на водные организмы. Тяжелые металлы по пищевым цепям попадают в организм человека.
Тяжелые металлы по характеру биологического воздействия можно подразделить на токсиканты и микроэлементы, имеющие принципиально различный характер влияния на живые организмы. Характер зависимости эффекта, оказываемого элементом на организмы, в зависимости от его концентрации в воде (и, следовательно, как правило, в тканях организма), приведен на рис. 3.
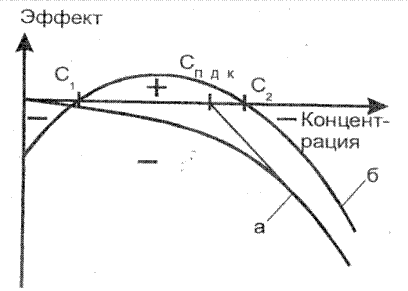
Рис.3. Характер эффекта, оказываемого элементом на организмы,
в зависимости от его концентрации в воде:
а – токсиканты, б – микроэлементы [11]
Как видно из рис. 3, токсиканты оказывают отрицательное воздействие на организмы при любой концентрации, в то время как микроэлементы имеют область недостаточности, вызывающей отрицательный эффект (менее С1), и область необходимых для жизни концентраций, при превышении которых снова возникает отрицательный эффект (более С2). Типичными токсикантами являются кадмий, свинец, ртуть; микроэлементами – марганец, медь, кобальт.
Ниже мы приводим краткие сведения о физиологической (в том числе токсической) активности некоторых тяжелых металлов [9, 15].
Медь. Медь является микроэлементом, содержится в организме человека, главным образом, в виде комплексных органических соединений и играет важную роль в процессах кроветворения. Во вредном воздействии избытка меди решающую роль играет реакция катионов Сu2+ с SН-группами ферментов. Изменение содержания меди в сыворотке и коже обусловливает явления депигментации кожи (витилиго). Отравление соединениями меди могут приводить к расстройствам нервной системы, нарушению функций печени и почек и др. ПДК меди в воде водоемов хозяйственно-питьевого и культурно-бытового назначения составляет 1,0 мг/л, лимитирующий показатель вредности – органолептический [36].
Цинк. Цинк является микроэлементом и входит с состав некоторых ферментов. Он содержится в крови (0,5-0,6), мягких тканях (0,7-5,4), костях (10-18), волосах (16-22 мг %), т.е., в основном, в костях и волосах. Находится в организме в динамическом равновесии, которое сдвигается в условиях повышенных концентраций в окружающей среде. Отрицательное воздействие соединений цинка может выражаться в ослаблении организма, повышенной заболеваемости, астмоподобных явлениях и др. ПДК цинка в воде водоемов составляет 1,0 мг/л, лимитирующий показатель вредности – общесанитарный [35].
Кадмий. Соединения кадмия очень ядовиты. Действуют на многие системы организма – органы дыхания и желудочно-кишечный тракт, центральную и периферическую нервные системы. Механизм действия соединений кадмия заключается в угнетении активности ряда ферментов, нарушении фосфорно-кальциевого обмена, нарушений метаболизма микроэлементов (Zn, Си, Fе, Мn, Sе). ПДК кадмия в воде водоемов составляет 0,001 мг/л, лимитирующий показатель вредности – санитарно-токсикологический.
Ртуть. Ртуть относится к ультрамикроэлементам и постоянно присутствует в организме, поступая с пищей. Неорганические соединения ртути (в первую очередь катионы Нg+) реагируют с
SH-группами белков («тиоловые яды»), а также с карбоксильными и аминными группами тканевых белков, образуя прочные комплексные соединения – металлопротеиды. В результате возникают глубокие нарушения функций центральной нервной системы, особенно высших ее отделов. Из органических соединений ртути наибольшее значение играет метилртуть, которая хорошо растворима в липидных тканях и быстро проникает в жизненно важные органы, и в том числе в мозг. В результате возникают изменения в вегетативной нервной системе, периферических нервных образованиях, в сердце, сосудах, кроветворных органах, печени и др., нарушения в иммунобиологическом состоянии организма. Соединения ртути обладают также эмбриотоксическим действием (приводят к поражению плода у беременных). ПДК ртути в воде водоемов составляет 0,0005 мг/л, лимитирующий показатель вредности – санитарно-токсикологический.
Свинец. Соединения свинца – яды, действующие на все живое, но вызывающие изменения особенно в нервной системе, крови и сосудах. Подавляют многие ферментативные процессы. Дети более восприимчивы к воздействию соединений свинца, чем взрослые. Обладают эмбриотоксическим и тератогенным действием, приводят к энцефалопатии и поражениям печени, угнетают иммунитет. Органические соединения свинца (тетраметилсвинец, тетраэтилсвинец) – сильные нервные яды, летучие жидкости. Являются активными ингибиторами обменных процессов. Для всех соединений свинца характерно кумулятивное действие. ПДК свинца в воде водоемов составляет 0,03 мг/л, лимитирующий показатель – санитарно-токсикологический.
Предлагаемый метод определения суммарного содержания металлов проводится в соответствии с ГОСТ 1030 и является экстракционно-колориметрическим. Метод основан на групповой реакции катионов металлов, относимых к тяжелым, – цинка, меди и свинца, а также некоторых других – с дитизоном, в результате которой образуются окрашенные в оранжево-красный цвет дитизонаты металлов. Реакцию проводят в слабощелочной среде, благодаря чему определяются металлы только в растворенной форме.
Металлы в виде дитизонатов концентрируются в воде путем их экстракции органическим растворителем, не смешивающимся с водой (обычно используют хлороформ, четыреххлористый углерод). Концентрацию суммы металлов определяют визуально-колориметрическим методом, сравнивая окраску раствора с контрольной шкалой образцов окраски. Благодаря процедуре концентрирования данный метод определения суммы металлов является чрезвычайно чувствительным, поэтому большое значение для успешного анализа имеет чистота посуды, аккуратность в работе, умение работать с реактивами особой чистоты. Данная модификация метода неприменима к анализу кислотных почвенных вытяжек, т.к. в сильнокислой среде значительно изменяются условия протекания аналитической реакции и спектральные характеристики образующихся продуктов.
Ориентировочное предельно допустимое значение содержания в водах суммы металлов составляет 0,001 ммоль/л (ГОСТ 24902) [7]. Значения ПДК для воды водоемов по отдельным металлам приведены ранее при описании их физиологического воздействия.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 623; Нарушение авторских прав?; Мы поможем в написании вашей работы!