
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическийколичественный
|
|
|
|
Оптика
Пример решения задач
38. На мыльную пленку с показателем преломления 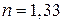 падает по нормали пучок лучей белого света. При какой наименьшей толщине пленки
падает по нормали пучок лучей белого света. При какой наименьшей толщине пленки 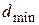 она в отраженном свете будет казаться зеленой (
она в отраженном свете будет казаться зеленой (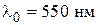 )?
)?
Дано:
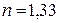
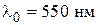
| Решение

|
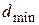 –? –?
|
Для того, чтобы в отраженном свете пленка выглядела зеленой, необходимо, чтобы при интерференции отраженных лучей выполнялось условие максимума для зеленой части спектра. Оптическая разность хода 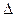 лучей 3 и 2, отраженных от нижней и верхней поверхностей пленки,
лучей 3 и 2, отраженных от нижней и верхней поверхностей пленки,
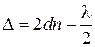 ,
,
(оптический ход в плёнке луча 3 больше луча 2 на 2 dn, но луч 2 отражается от оптически более плотной среды, поэтому его ход скачком увеличивается на  ). Условие максима:
). Условие максима:
 ,
,
где k = 0, 1, 2…. Наименьшая толщина пленки будет при k = 0, тогда
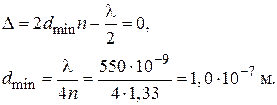
Ответ: 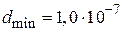 м.
м.
39. На прозрачную дифракционную решетку с периодом 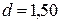 мкм падает нормально монохроматический свет с длинной волны
мкм падает нормально монохроматический свет с длинной волны 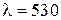 нм. Найти: а) наибольший порядок
нм. Найти: а) наибольший порядок  главного дифракционного максимума; б) угол дифракции
главного дифракционного максимума; б) угол дифракции  главного дифракционного максимума наибольшего порядка.
главного дифракционного максимума наибольшего порядка.
Дано:
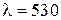 нм нм
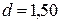 мкм мкм
| Решение
Условие главного дифракционного максимума порядка 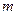 имеет вид имеет вид
 , ( , (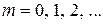 ), ),
|
а)  –?
б) –?
б) 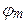 –? –?
| где  – угол дифракции, соответствующего главного максимума – угол дифракции, соответствующего главного максимума
|
Как следует из выпеприведенной формулы, наибольший порядок дифракционного максимума должен удовлетворять соотношению 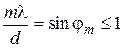 .
.
Отсюда имеем 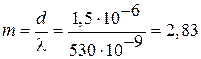 . Поскольку угол
. Поскольку угол  не может быть больше
не может быть больше  , а m должно быть целым, то выбираем m = 2. Для соответствующего угла дифракции получим
, а m должно быть целым, то выбираем m = 2. Для соответствующего угла дифракции получим  =
= 
Ответ: а) 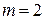 ; б)
; б) 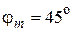
40. Луч света, падающий на поверхность кристалла каменной соли, при отражении максимально поляризуется, если угол падения  равен 57°. Найти: а) показатель преломления
равен 57°. Найти: а) показатель преломления 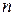 кристалла каменной соли; б) скорость распространения
кристалла каменной соли; б) скорость распространения 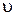 света в этом кристалле.
света в этом кристалле.
Дано:

| Решение
Согласно закону Брюстера отраженный луч света максимально поляризован, если угол падения луча удовлетворяет соотношению
 . (1) . (1)
|
а) 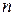 –?
б) –?
б)  –? –?
|
Скорость света в кристалле может быть найдена из известного соотношения:
 , (2)
, (2)
где 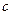 – скорость света в вакуме. Поэтому из формул (1) и (2) имеем
– скорость света в вакуме. Поэтому из формул (1) и (2) имеем
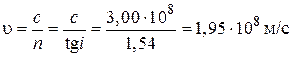 .
.
Ответ: а) 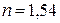 б)
б) 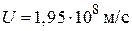
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
4.15. На мыльную пленку с показателем преломления n = 1,33 падает по нормали монохроматический свет с длиной волны l = 0,60 мкм. Отраженный свет в результате интерференции имеет наибольшую яркость. Какова наименьшая возможная толщина плёнки dmin?
(0,11 мкм)
4.16. Плоская световая волна длиной l0 в вакууме падает по нормали на прозрачную пластинку с показателем преломления n. При каких толщинах b пластинки отраженная волна будет иметь:
а) максимальную интенсивность;
б) минимальную интенсивность?
(а) b = (l0/2 n)(m +0,5) (m = 1, 2, 3...); б) b = (l0/2 n) m (m = 1,2,3...))
|
Красная линия (l = 6300 Å) видна в спектре 3-го порядка под углом j = 60°.
Определить:а) какая спектральная линия видна под этим же углом в спектре 4-го порядка; б) какое число штрихов на 1 мм длины имеет дифракционная решетка.
(l = 475 нм; N = 460 мм-1)
4.18. Пластина кварца толщиной d 1 = 1,0 мм, вырезанная перпендикулярно оптической оси кристалла, поворачивает плоскость поляризации монохроматического света определенной длины волны на угол j1 = 20°. Определить:
а) какова должна быть длина d 2 кварцевой пластинки, помещенной между двумя “параллельными” николями, чтобы свет был полностью погашен;
б) какой длины l трубку с раствором сахара концентрации С = 0,40 кг/л надо поместить между николями для получения того же эффекта.
Удельное вращение раствора сахара a0 = 0,665 град/(м-2×кг).
(d 2 = 4,5 мм; l = 3,4 дм)
4.19. Под каким углом к горизонту должно находиться солнце, чтобы его лучи, отраженные от поверхности озера, стали бы наиболее полно поляризованы, если скорость света в воде 2,26×108 м/с?
(37°)
4.20. Источник света диаметром d = 30,0 см находится от места наблюдателя на расстоянии l = 200 м. В излучении источника содержатся волны длиной от 490 до 510 нм. Оценить для этого излучения: а) время когерентности 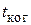 ; б) длину когерентности
; б) длину когерентности  ; в) радиус когерентности
; в) радиус когерентности 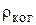 .
.
(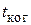
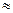
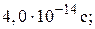

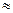 0,010 мм;
0,010 мм; 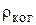
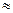 0,30 мм)
0,30 мм)
4.21. Пластинка кварца толщиной d = 4,0 мм (удельное вращение кварца 15 град/мм), вырезанная перпендикулярно оптической оси, помещена между двумя скрещенными николями. Пренебрегая потерями света в николях, определите, во сколько раз уменьшится интенсивность света, прошедшего эту систему.
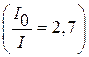 .
.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Таблица вариантов задач к разделу «Механика»
| Вариант | Номер задачи | ||||
| 1.1 | 1.16 | 1.22 | 1.44 | 1.65 | |
| 1.2 | 1.17 | 1.23 | 1.45 | 1.66 | |
| 1.3 | 1.18 | 1.25 | 1.46 | 1.67 | |
| 1.4 | 1.19 | 1.26 | 1.47 | 1.68 | |
| 1.5 | 1.20 | 1.27 | 1.48 | 1.69 | |
| 1.6 | 1.21 | 1.28 | 1.49 | 1.70 | |
| 1.7 | 1.16 | 1.29 | 1.50 | 1.71 | |
| 1.8 | 1.17 | 1.30 | 1.51 | 1.71 | |
| 1.9 | 1.18 | 1.31 | 1.52 | 1.65 | |
| 1.10 | 1.19 | 1.32 | 1.53 | 1.66 | |
| 1.11 | 1.20 | 1.33 | 1.67 | ||
| 1.12 | 1.21 | 1.34 | 1.55 | ||
| 1.16 | 1.35 | 1.56 | 1.69 | ||
| 1.14 | 1.17 | 1.36 | 1.57 | 1.70 | |
| 1.15 | 1.18 | 1.37 | 1.58 | 1.71 | |
| 1.1 | 1.19 | 1.71 | |||
| 1.2 | 1.20 | 1.39 | 1.60 | 1.65 | |
| 1.3 | 1.21 | 1.40 | 1.61 | 1.66 | |
| 1.16 | 1.41 | 1.62 | |||
| 1.5 | 1.17 | 1.42 | 1.63 | 1.68 | |
| 1.6 | 1.18 | 1.43 | 1.69 | ||
| 1.7 | 1.19 | 1.22 | 1.45 | 1.70 | |
| 1.8 | 1.20 | 1.23 | 1.46 | 1.71 | |
| 1.9 | 1.21 | 1.25 | 1.47 | 1.71 | |
| 1.10 | 1.16 | 1.26 | 1.48 | 1.65 | |
| 1.11 | 1.17 | 1.27 | 1.49 | 1.66 | |
| 1.12 | 1.18 | 1.28 | 1.50 | 1.67 | |
| 1.13 | 1.19 | 1.29 | 1.51 | 1.68 | |
| 1.14 | 1.20 | 1.30 | 1.52 | 1.69 | |
| 1.15 | 1.21 | 1.31 | 1.53 | 1.70 |
Таблица вариантов задач к разделу
«Молекулярная физика и термодинамика»
| Вариант | Номер задачи | ||||
| 2.1 | 2.6 | 2.12 | 2.20 | 2.33 | |
| 2.2 | 2.7 | 2.13 | 2.21 | 2.34 | |
| 2.3 | 2.8 | 2.14 | 2.22 | 2.35 | |
| 2.4 | 2.9 | 2.15 | 2.23 | 2.36 | |
| 2.5 | 2.10 | 2.16 | 2.24 | 2.37 | |
| 2.1 | 2.11 | 2.17 | 2.25 | 2.33 | |
| 2.2 | 2.6 | 2.18 | 2.26 | 2.34 | |
| 2.3 | 2.7 | 2.19 | 2.27 | 2.35 | |
| 2.4 | 2.8 | 2.12 | 2.28 | 2.36 | |
| 2.5 | 2.9 | 2.13 | 2.29 | 2.37 | |
| 2.1 | 2.10 | 2.14 | 2.30 | 2.33 | |
| 2.2 | 2.11 | 2.15 | 2.31 | 2.34 | |
| 2.3 | 2.6 | 2.16 | 2.32 | 2.35 | |
| 2.4 | 2.7 | 2.17 | 2.20 | 2.36 | |
| 2.5 | 2.8 | 2.18 | 2.21 | 2.37 | |
| 2.1 | 2.9 | 2.19 | 2.22 | 2.33 | |
| 2.2 | 2.10 | 2.12 | 2.23 | 2.34 | |
| 2.3 | 2.11 | 2.13 | 2.24 | 2.35 | |
| 2.4 | 2.6 | 2.14 | 2.25 | 2.36 | |
| 2.5 | 2.7 | 2.15 | 2.26 | 2.37 | |
| 2.1 | 2.8 | 2.16 | 2.27 | 2.33 | |
| 2.2 | 2.9 | 2.17 | 2.28 | 2.34 | |
| 2.3 | 2.10 | 2.18 | 2.29 | 2.35 | |
| 2.4 | 2.11 | 2.19 | 2.30 | 2.36 | |
| 2.5 | 2.6 | 2.12 | 2.31 | 2.37 | |
| 2.1 | 2.7 | 2.13 | 2.32 | 2.33 | |
| 2.2 | 2.8 | 2.14 | 2.20 | 2.34 | |
| 2.3 | 2.9 | 2.15 | 2.21 | 2.35 | |
| 2.4 | 2.10 | 2.16 | 2.22 | 2.36 | |
| 2.5 | 2.11 | 2.17 | 2.23 | 2.37 |
Таблица вариантов задач к разделу
«Электричество и магнетизм»
| Вариант | Номер задачи | ||||
| 3.1 | 3.10 | 3.16 | 3.23 | 3.33 | |
| 3.2 | 3.11 | 3.17 | 3.24 | 3.34 | |
| 3.3 | 3.12 | 3.18 | 3.25 | 3.35 | |
| 3.4 | 3.13 | 3.19 | 3.26 | 3.36 | |
| 3.5 | 3.14 | 3.20 | 3.27 | 3.33 | |
| 3.6 | 3.15 | 3.21 | 3.28 | 3.34 | |
| 3.7 | 3.10 | 3.22 | 3.29 | 3.35 | |
| 3.8 | 3.11 | 3.16 | 3.30 | 3.36 | |
| 3.9 | 3.12 | 3.17 | 3.31 | 3.37 | |
| 3.1 | 3.13 | 3.18 | 3.32 | 3.38 | |
| 3.2 | 3.14 | 3.19 | 3.23 | 3.39 | |
| 3.3 | 3.15 | 3.20 | 3.24 | 3.40 | |
| 3.4 | 3.10 | 3.21 | 3.25 | 3.33 | |
| 3.5 | 3.11 | 3.22 | 3.26 | 3.34 | |
| 3.6 | 3.12 | 3.16 | 3.27 | 3.35 | |
| 3.7 | 3.13 | 3.17 | 3.28 | 3.36 | |
| 3.8 | 3.14 | 3.18 | 3.29 | 3.37 | |
| 3.9 | 3.15 | 3.19 | 3.30 | 3.38 | |
| 3.1 | 3.10 | 3.20 | 3.31 | 3.39 | |
| 3.2 | 3.11 | 3.21 | 3.32 | 3.40 | |
| 3.3 | 3.12 | 3.22 | 3.23 | 3.33 | |
| 3.4 | 3.13 | 3.16 | 3.24 | 3.34 | |
| 3.5 | 3.14 | 3.17 | 3.25 | 3.35 | |
| 3.6 | 3.15 | 3.18 | 3.26 | 3.36 | |
| 3.7 | 3.10 | 3.19 | 3.27 | 3.37 | |
| 3.8 | 3.11 | 3.20 | 3.28 | 3.38 | |
| 3.9 | 3.12 | 3.21 | 3.29 | 3.39 | |
| 3.1 | 3.13 | 3.22 | 3.30 | 3.40 | |
| 3.2 | 3.14 | 3.16 | 3.31 | 3.37 | |
| 3.3 | 3.15 | 3.17 | 3.32 | 3.39 |
Таблица вариантов задач к разделу «Колебания, волны, оптика»
| Вариант | Номер задачи | |||
| 4.1 | 4.7 | 4.8 | 4.15 | |
| 4.2 | 4.6 | 4.9 | 4.16 | |
| 4.3 | 4.5 | 4.9 | 4.17 | |
| 4.4 | 4.5 | 4.10 | 4.18 | |
| 4.1 | 4.6 | 4.11 | 4.19 | |
| 4.2 | 4.7 | 4.12 | 4.20 | |
| 4.3 | 4.5 | 4.13 | 4.21 | |
| 4.4 | 4.6 | 4.14 | 4.17 | |
| 4.1 | 4.7 | 4.8 | 4.18 | |
| 4.2 | 4.5 | 4.9 | 4.19 | |
| 4.3 | 4.6 | 4.9 | 4.20 | |
| 4.4 | 4.7 | 4.10 | 4.16 | |
| 4.1 | 4.5 | 4.11 | 4.17 | |
| 4.2 | 4.6 | 4.13 | 4.18 | |
| 4.3 | 4.6 | 4.14 | 4.19 | |
| 4.4 | 4.5 | 4.14 | 4.15 | |
| 4.1 | 4.6 | 4.8 | 4.21 | |
| 4.2 | 4.7 | 4.9 | 4.17 | |
| 4.3 | 4.5 | 4.9 | 4.18 | |
| 4.4 | 4.6 | 4.8 | 4.19 | |
| 4.1 | 4.7 | 4.10 | 4.15 | |
| 4.2 | 4.5 | 4.11 | 4.16 | |
| 4.3 | 4.6 | 4.12 | 4.17 | |
| 4.4 | 4.5 | 4.13 | 4.18 | |
| 4.1 | 4.5 | 4.14 | 4.19 | |
| 4.2 | 4.6 | 4.9 | 4.20 | |
| 4.3 | 4.6 | 4.9 | 4.21 | |
| 4.4 | 4.5 | 4.8 | 4.17 | |
| 4.1 | 4.6 | 4.10 | 4.18 | |
| 4.2 | 4.7 | 4.11 | 4.19 |
СПИСОК РЕКОМЕНДОВАННОЙ ЛИТЕРАТУРЫ*
1. Кунин, В. Н. Программа по физике / В. Н. Кунин, К. И. Пак; Владим. гос. техн. ун-т. – Владимир: 1992. – 32 с.
2. Детлаф, А. А. Курс физики / А. А. Детлаф, Б. М. Яворский. – М.: Наука, 1987. – 607 с.
3. Савельев, И. В. Курс общей физики. В 3 т. Т. 1 / И. В. Савельев. – М.: Наука, 1987. – 432 с.
4. Он же. Курс общей физики. В 3 т. Т. 2 / И. В. Савельев. – М.: Наука,1988. – 496 с.
5. Трофимова, Т. И. Курс физики / Т. И. Трофимова. – М.: Высш. шк., 1990. – 478 с.
6. Сивухин, Д. В. Общий курс физики. В 5 т. Т. 1 / Д. В. Сивухин. – М.: Наука, 1974. – 519 с.
7. Он же. Общий курс физики. В 5 т. Т. 2 / Д. В. Сивухин. – М.: Наука, 1975. – 551 с.
8. Он же. Общий курс физики. В 5 т. Т. 3 / Д. В. Сивухин. – М.: Наука, 1977. – 687 с.
9. Он же. Общий курс физики. В 5 т. Т. 4 / Д. В. Сивухин. – М.: Наука, 1980. – 751 с.
10. Калашников, Э. Г. Электричество / Э. Г. Калашников. – М.: Наука, 1997. – 590 с.
11. Ландсберг, Г. С. Оптика / Г. С. Ландсберг. – М.: Наука, 1976. – 926 с.
12. Волькенштейн, В. С. Сборник задач по общему курсу физики / В. С. Волькенштейн. – М.: Наука, 1979. – 351 с.
13. Савельев, И. В. Сборник вопросов и задач по общей физике / И. В. Савельев. – М.: Наука, 1988. – 288 с.
14. Иродов, И. Е. Сборник задач по общей физике / И. Е. Иродов, И. В. Савельев, О. И. Замша. – М.: Наука, 1975. – 319 с.
15. Физика: программа, методические указания и задачи для студентов-заочников (с примерами решения); Владим. гос. ун-т.; сост.: А. Ф. Галкин [и др.]; под ред. А. А. Кулиша. – Владимир, 2002. – 128 с.
16. Трофимова, Т. П. Сборник задач по курсу физики с решениями / Т. П. Трофимова, З. Г. Павлова. – М.: Высш. шк., 1999. – 591 с.
17. Стрелков, С. П. Механика / С. П. Стрелков. – М.: Наука, 1975. – 559 с.
18. Годжаев, Н. М. Оптика / Н. М. Годжаев. – М.: Высш. шк., 1977. – 432 с.
ОГЛАВЛЕНИЕ
Цели и задачи курса физики, его место в учебном процессе...... 3
Общие методические указания.................................................... 5
Программа.................................................................................... 7
Вопросы, входящие в экзаменационые билеты......................... 15
Темы практических занятий...................................................... 21
Список лабораторных работ...................................................... 22
Примерные темы курсовых работ............................................. 24
Программа коллоквиумов.......................................................... 25
Зачетные требования................................................................... 26
Вопросы и задачи по физике с примерами решения................. 29
Контрольные задания................................................................. 39
Список рекомендуемой литературы........................................ 124
МЕТОДИЧЕСКИЕ УКАЗАНИЯ, ПРОГРАММА,
ВОПРОСЫ И ЗАДАЧАМИ ПО ФИЗИКЕ
Составили
КУНИН Владимир Николаевич
ГАЛКИН Аркадия Федорович
Подписано в печать 09.02.07.
Формат 60х84/16. Усл. печ. л.?,??. Тираж?00 экз.
Заказ
Издательство
Владимирского государственного университета.
 600000, Владимир, ул. Горького, 87.
600000, Владимир, ул. Горького, 87.
* В скобках указаны номера лабораторных работ.
* Можно использовать издания более поздних годов выпуска.
АНАЛИЗ.
Целью и задачей количественного анализа является определение точного содержания отдельных элементов или их соединений в анализируемом объекте.
Методы исследования в количественном анализе.
Количественный анализ, как и качественный, проводят химическими или приборными (физико-химическими, физическими) методами. Во всех методах количественного анализа прибегают к точному измерению определенной физической величины, например, массы, объема, интенсивности окраски, электрической проводимости и т.д.
К достоинствам инструментальных методов анализа относятся: низкий предел обнаружения (до 10-9 мкг, предельная концентрация до 10-15 г/мл определяемого вещества), а также селективность (определение основных компонентов без их разделения), быстрота проведения анализа, возможность их автоматизации. Недостатки их - сравнительно большая ошибка определения по сравнению с химическими методами (от 5% до 20%, а для химического анализа - 0,1 – 0,5 %). Поэтому методы химического анализа по-прежнему являются стандартными при оценке правильности определений другими методами.
Среди химических методов различают весовые (гравиметрические) и объемные (титриметрические и газоволюметрические). Эти методы основаны на измерении массы осадка (продукта реакции), образовавшегося в результате химической реакции, или объема реагента (одного из исходных веществ), затраченного на химический процесс.
Химические методы количественного анализа связаны с определённой химической реакцией (или системой реакций), например:
Х + Р → П
где Х - определяемый компонент; Р – реагент в аналитической реакции; П – продукт реакции.
Для определения количества компонента Х можно:
1) определить количество продукта реакции П;
2) определить количество затраченного реагента Р.
Вариант 1) используется в гравиметрическом, а вариант 2) - в титриметрическом методах химического количественного анализа.
Гравиметрический анализ – метод химического количественного анализа, основанный на точном измерении массы продукта реакции П, выделенного в химически чистом состоянии в виде соединения точно известного состава.
Титриметрический анализ – метод химического количественного анализа, основанный на измерении объёма раствора реактива Р точно известной концентрации, израсходованного на реакцию с данным количеством определяемого вещества Х. В основе расчётов в титриметрическом методе лежит закон эквивалентов.
Преимуществом гравиметрического метода является более высокая точность, чем у титриметрического метода: погрешность определения в нём составляет 0,01 – 0.005 %, а в титриметрическом – 0,1 – 0,05 %. В ряде случаев гравиметрия – лучший способ решения аналитической задачи. Это абсолютный (эталонный) метод.Основной недостаток гравиметрического метода – его длительность по сравнению с титриметрическим (от нескольких часов до нескольких суток).
Преимуществом титриметрического метода является его более высокая скорость выполнения анализа (экспрессность).
Гравиметрический и титриметрический методы являются классическими методами аналитической химии. Несмотря на широкое использование приборных методов анализа, они применяются как в исследовательской, так и в производственной практике и в ряде случаев незаменимы.
В основе химических методов обнаружения (определения) лежат химические реакции трёх типов: кислотно-основные, окислительно-восстановительные и реакции комплексообразования.
К реакциям в химическом анализе предъявляются определённые требования, важнейшими из которых являются следующие:
1. реакции должны протекать быстро, до конца, по возможности при комнатной температуре;
2. исходные вещества, вступающие в реакцию, должны реагировать в строго определённых, т.е. стехиометрических соотношениях и без побочных процессов;
3. примеси не должны мешать проведению количественного анализа.
1. Гравиметрический анализ.
1.1 Основные понятия гравиметрического анализа. или по другому?
Гравиметрический метод анализа основан на точном измерении массы вещества, выделенного в виде соединения известного состава или в элементарном виде. Метод базируется на законе сохранения массы в химических реакциях. Для определения веществ методом гравиметрии используют способы осаждения или отгонки. При отгонке определяемое вещество отгоняют в виде летучего соединения. Способ отгонки менее распространён, чем осаждение.
Общая схема гравиметрического анализа состоит из следующих этапов:
1) расчёт массы навески анализируемой пробы и массы (или объёма) осадителя;
2) взвешивание навески анализируемого образца;
3) переведение образца в раствор;
4) осаждение соединения, содержащего определяемый компонент, в виде осаждаемой формы;
5) отфильтровывание и промывание осадка;
6) высушивание в сушильном шкафу при температуре 100 -125°С;
7) прокаливание осаждённой формы при 600 – 900 °С для превращения её в гравиметрическую;
8) взвешивание полученной гравиметрической формы;
9) расчёт содержания определяемого компонента в образце.
Например, ионы Ca2+ в солях можно определить методом осаждения, используя в качестве реактива оксалат аммония:
CaCl2 + (NH4)2C2O4 = CaC2O4(тв.) + 2NH4Cl.
Осадок CaC2O4 промывают, высушивают и прокаливают. При этом оксалат кальция переходит в оксид кальция:
CaC2O4 = CaO +CO2↑ + CO↑ (t > 200 °C).
Образовавшийся оксид кальция взвешивают и по его количеству рассчитывают содержание кальция в анализируемом веществе.
В связи с тем, что многие осадки при последующем прокаливании изменяют свой состав, различают осаждаемую и гравиметрическую, или весовую форму осадка. В примере с определением кальция CaC2O4 – осаждаемая форма - перешла в весовую - CaO.
В ряде случаев, например, при осаждении Ba2+ серной кислотой, состав осаждаемой и весовой форм совпадает.
Ba2+ + SO42- = BaSO4.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 728; Нарушение авторских прав?; Мы поможем в написании вашей работы!