
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Этапы гравиметрического анализа
|
|
|
|

1.2.1. Расчет масс навесок анализируемого вещества и осадителя.
Масса навески, предназначенной для анализа, берётся не произвольно. Слишком маленькая масса приводит к большой относительной ошибке анализа; слишком большая - замедляет все этапы анализа. Расчёт оптимальной массы навески производят, исходя из того, что масса гравиметрической формы должна быть не менее 0,1 - 0,3 г, если осаждаемая форма - аморфное вещество, и 0,1 – 0,5 г, если осаждаемая форма - кристаллическое вещество.
Пример 1. Рассчитать массынавесок анализируемого вещества и осадителя по уравнению реакции (1):
H2SO4 + BaCl2 = BaSO4↓+ 2HCl (1),
где H2SO4 – анализируемое вещество; BaCl2 - осадитель. BaSO4 – осаждаемая форма - кристаллический осадок. Оптимальная масса для дальнейшего прокаливания - 0,5 г.
Рассчитаем массу навески H2SO4, согласно выше приведённой реакции по пропорции:
 =
= 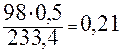 г.
г.
где  - масса H2SO4 в анализируемой пробе, г:
- масса H2SO4 в анализируемой пробе, г: 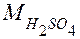 - молярная масса H2SO4 , г/моль;
- молярная масса H2SO4 , г/моль; 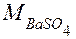 - молярная масса ВаSO4, г/моль.
- молярная масса ВаSO4, г/моль.
Определив с помощь ареометра плотность и по соответствующей таблице примерную концентрацию H2SO4 (в % масс), воспользуемся известными соотношениями и рассчитаем по массе навески H2SO4 её объём (жидкости удобнее приливать, чем взвешивать):

Если анализируют большое количество образцов одного и того же материала, для расчёта массы навески удобно пользоваться гравиметрическим фактором (коэффициентом пересчёта) F. Тогда нижний предел оптимальной массы m(х) исходной навески анализируемого вещества рассчитывается по формуле (1):

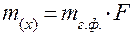 , г (1),
, г (1),
или 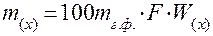 (1а)
(1а)
где 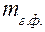 – масса гравиметрической формы в г, F– гравиметрический фактор (фактор пересчёта), W (х) - массовая доля в процентах определяемого компонента в анализируемом веществе
– масса гравиметрической формы в г, F– гравиметрический фактор (фактор пересчёта), W (х) - массовая доля в процентах определяемого компонента в анализируемом веществе
Гравиметрический факторF равен массе определяемого компонента в граммах, соответствующей 1 грамму гравиметрической формы. Гравиметрический фактор F рассчитывается по формуле (2):
 (2),
(2),
где МХ – молярная масса определяемого компонента x, а M г. ф. - молярная масса гравиметрической формы, n – число молей определяемого компонента, из которого получается 1 моль гравиметрической формы. Например, из 2 молей хлорида алюминия AlCl3 получается 1 моль оксида Al2O3, следовательно, в данном случае n=2. А из 1 моля нитрата бария Ba(NO3)2 можно получить 1 моль хромата бария BaCrO4, cледовательно, в последнем случае n = 1.
Чем ниже F, тем ниже относительная погрешность результатов определения, поэтому в качестве осадителей часто используют органические молекулы с большой массой
Гравиметрические факторы, наиболее часто используемые в аналитической практике, приведены ниже в таблице I.
Расчёт количества (объёма или массы) осадителя ведут с учётом возможного содержания определяемого компонента в анализируемой пробе.
Расчёт  проводим с учётом кристаллизационной воды в составе твёрдой соли также по уравнению реакции (1):
проводим с учётом кристаллизационной воды в составе твёрдой соли также по уравнению реакции (1):

 =
=  г
г
. Необходимое минимальное количество осадителя рассчитывается по уравнению реакции в соответствии с навеской определяемого вещества. Для более полного осаждения осадитель берут в избытке в ≈ 1,5 раза, если осадитель не летуч (как BaCl2∙2Н2О). Если осадитель летуч, то есть удаляется при нагревании осадка (например, раствор HCl) то берут 2-3 - кратный избыток его по сравнению с рассчитанным количеством.
Слишком большой избыток может вызвать растворение осадка вследствие комплексообразования, амфотерности, солевого эффекта и т.п.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 1611; Нарушение авторских прав?; Мы поможем в написании вашей работы!