
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы аналитических реакций и реагентов
|
|
|
|
Аналитические реакции и аналитические реагенты часто (обычно) подразделяют на специфические (специфичные, характерные), селективные (избирательные) и групповые.
Специфические реагенты и реакции позволяют обнаруживать данное вещество или данный ион в присутствии других веществ или ионов.
Так, например, если в растворе присутствует молекулярный иод I2, (точнее, более сложное соединение – трииодид-ион I3–), то при прибавлении свежеприготовленного водного раствора крахмала исходный раствор окрашивается в синий цвет. Процесс – обратимый; при исчезновении в растворе молекулярного иода (например, при его восстановлении до иодид-ионов I–) синяя окраска также исчезает и раствор обесцвечивается. Эта реакция широко используется в качественном и количественном химическом анализе. Впервые ее описал в 1815 г. немецкий химик Ф. Штромейер.
Синее окрашивание раствора крахмала в присутствии иода (именно трииодид-ионов, т.к. чистый молекулярный иод I2 даже в отсутствии иодид-ионов I– не окрашивает крахмал) объясняют образованием адсорбционного комплекса между коллоидными макромолекулами крахмала (фракциями неразветвленной амилозы) и трииодид-ионами.
Специфическим реагентом на нитрит-ионы NO2, является реактив Грисса – Илошвая (Илосвая), представляющий собой смесь α-нафтиламина С10H7NH2 и сульфаниловой кислоты НО3SC6Н4NH2), с которым нитрит-ион (обычно в присутствии уксусной кислоты) образует азокраситель НО3SС6Н4N = NС10Н6NН2 красного цвета:
НО3SC6Н4NH2 + HNO2 + С10H7NH2 → НО3SС6Н4N=NС10Н6NН2 + 2H20
Смесь α-нафтиламина с сульфаниловой кислотой в качестве специфического реагента на нитриты была впервые предложена в 1879 г. немецким химиком П.Гриссом. Позднее эта реакция изучалась венгерским химиком Л. Илошваем (Илосваем). В современной аналитической химии указанную смесь обычно называют «реактив (реагент) Грисса – Илосвая» или просто «реактив Грисса», а соответствующую реакцию – «реакцией Грисса – Илосвая» или «реакцией Грисса». Вместо α-нафтиламина применяют также нафтолы.
В качестве специфического реагента на ионы никеля Ni2+ часто используют реактив Чугаева – диметилглиоксим, который в присутствии катионов Ni2+ в аммиачной среде образует малорастворимый в воде комплекс красного цвета – бисдиметилглиоксимат никеля(П), который традиционно называют никельдиметилглиоксимом:
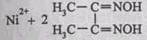
↓

Диметилглиоксим как специфический и очень чувствительный реагент на ионы никеля Ni2+ был впервые предложен русским химиком Л.А. Чугаевым в 1905 г. и назван впоследствии его именем («реактив Чугаева»).
Специфических аналитических реагентов и реакций известно довольно мало.
Селективные реагенты и реакции позволяют обнаруживать (одновременно!) несколько веществ или ионов (например, кристаллографические реакции, когда под микроскопом одновременно видны несколько типов кристаллов). Таких реагентов и реакций известно значительно больше, чем специфических.
Групповые реагенты и реакции (частный случай селективных) позволяют обнаруживать все ионы определенной аналитической группы (но при этом их аналитические эффекты суммируются).
Так, например, хлороводородная кислота НСl и растворимые в воде хлориды (NaСl, KСl, NH4Сl и т. д.) являются групповыми реагентами на группу катионов, состоящую из ионов одновалентного серебра Ag+, «одновалентной» ртути Hg22+ и двухвалентного свинца Рb2+ Точнее говоря, в роли группового реагента здесь выступают хлорид-ионы Сl--, образующие с указанными катионами металлов малорастворимые в воде белые осадки хлоридов этих катионов:
Ag+ + Сl-- → AgCl ↓
Hg22+ + 2Сl-- → Hg2Cl2 ↓
Рb2+ +2Сl-- → РbCl2 ↓
Аналогично серная кислота H2SO4 и растворимые сульфаты (Na2SO4, K2SO4, (NH4)2SO4 и т.д.) являются групповыми реагентами на группу двухвалентных катионов кальция Са2+, стронция Sr2+ и бария Ва2+. С указанными катионами сульфат-анион SO42-- (собственно групповой реагент) дает малорастворимые в воде сульфаты, выпадающие в виде белых осадков:
Ca2+ + SO42-- → CaSO4 ↓
Sr2+ + SO42-- → SrSO4 ↓
Ba2+ + SO42-- → BaSO4 ↓
Существуют групповые реагенты и для других групп катионов и анионов, а также органических соединений, имеющих в своей структуре одну и ту же функциональную группу (например, амино-группу, гидрокси-группу и др.).
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 10789; Нарушение авторских прав?; Мы поможем в написании вашей работы!