
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Третье начало термодинамики
|
|
|
|
Энтропия любой системы стремится к нулю при стремлении к нулю температуры:
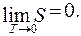 (9.23)
(9.23)
Эта теорема принадлежит В. Нернсту (1906 г.). Поскольку достижение абсолютного нуля невозможно, т.к. всегда существуют какие – либо формы движения материи, то невозможно нулевое значение энтропии.
9.6. Теплоёмкость идеального газа
Основные законы термодинамики были установлены опытным путём. Можно показать, что такие характеристики системы, как теплоёмкость, внутренняя энергия, энтропия и др. могут быть получены методами термодинамики и методами статистической физики.
Число степеней свободы системы i – количество независимых координат, с помощью которых можно полностью описать положение системы в пространстве. Так, для одноатомной молекулы i = 3, т.к. необходимо задать три координаты молекулы, например, координаты x, y, z в декартовой системе. Для двухатомной молекулы i = 3+3-1=5, т.к. число степеней свободы уменьшается на число жёстких связей между атомами, в данном случае на единицу. Если молекула может совершать колебательное и вращательное движения, то число степеней свободы увеличивается: i = nпост+nвращ+2nколеб. Опытным путём в термодинамике было доказано, что на каждую степень свободы приходится энергия  . Рассчитываем, например, внутреннюю кинетическую энергию системы из N молекул идеального газа, учитывая, что поступательному движению отдельной молекулы соответствует 3 степени свободы:
. Рассчитываем, например, внутреннюю кинетическую энергию системы из N молекул идеального газа, учитывая, что поступательному движению отдельной молекулы соответствует 3 степени свободы:
 (9.24)
(9.24)
Методами статистической физики было доказано, что внутренняя энергия идеального газа равна суммарной средней кинетической энергии движения молекул:
 (9.25)
(9.25)
Средняя кинетическая энергия молекул:
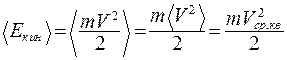 (9.26)
(9.26)
где Vср.кв – среднеквадратичная скорость молекул.
Из распределения Максвелла частиц по скоростям следует, что квадрат среднеквадратичной скорости пропорционален абсолютной температуре:
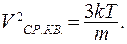 (9.27)
(9.27)
Подставим (9.26) и (9.27) в соотношение (9.25) и находим:
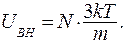 (9.28)
(9.28)
Таким образом, термодинамическими и статистическими методами мы пришли к одинаковому результату. В общем случае внутренняя энергия n молей идеального газа:
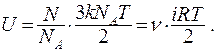 (9.29)
(9.29)
где 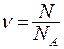 - количество молей газа,
- количество молей газа,  - универсальная газовая постоянная.
- универсальная газовая постоянная.
Применим первое начало термодинамики для получения теплоемкости идеального газа. Пусть имеется 1 моль идеального газа. Теплоемкость, по определению, равна количеству теплоты, необходимому для изменения температуры системы на один Кельвин:
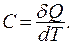 (9.30)
(9.30)
Молярной теплоемкостью называется теплоемкость одного моля вещества. Размерность молярной теплоемкости 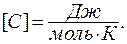 Удельной называется теплоемкость единицы массы вещества:
Удельной называется теплоемкость единицы массы вещества: 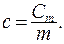 Размерность удельной теплоемкости:
Размерность удельной теплоемкости: 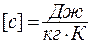 . Между удельной и молярной теплоемкостями существует связь
. Между удельной и молярной теплоемкостями существует связь  где m - молярная масса вещества.
где m - молярная масса вещества.
При протекании изохорного процесса (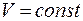 ) теплоемкость одного моля вещества:
) теплоемкость одного моля вещества:

Из первого начала термодинамики следует:
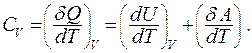
В изохорном процессе газ не совершает работы, 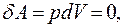 отсюда следует:
отсюда следует:
 (9.31)
(9.31)
Изменение внутренней энергии в изохорном процессе для произвольного количества вещества:
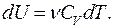 (9.32)
(9.32)
При протекании изобарного процесса (P = const), теплоемкость одного моля вещества:
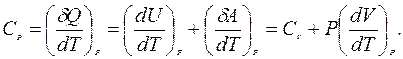 (9.33)
(9.33)
Из уравнения Менделеева – Клапейрона для одного моля газа находим:
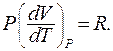 (9.34)
(9.34)
Из (9.33) и (9.34) следует, что теплоемкость идеального газа при постоянном давлении:
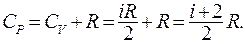 (9.35)
(9.35)
Уравнение, связывающие молярные теплоемкости CP и CV называется уравнением Роберта – Майера:
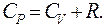 (9.36)
(9.36)
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 511; Нарушение авторских прав?; Мы поможем в написании вашей работы!