
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные газовые законы в химии
61. Уравнение состояния газа выведено Д.И. Менделеевым и Клайпероном. Оно записывается: 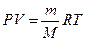 , где Р - давление, при котором находится газ, V - объем газа, m - масса газа, М - молекулярная масса газа, R - молярная газовая постоянная, Т - температура системы. Уравнение также называется уравнением Менделеева-Клайперона. Пример: найти объем 3-х моль газа, находящегося при 106.8 кПа и температуре 400К:
, где Р - давление, при котором находится газ, V - объем газа, m - масса газа, М - молекулярная масса газа, R - молярная газовая постоянная, Т - температура системы. Уравнение также называется уравнением Менделеева-Клайперона. Пример: найти объем 3-х моль газа, находящегося при 106.8 кПа и температуре 400К: 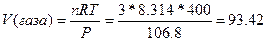 литра.
литра.
62. 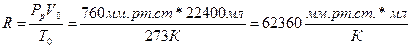
63. а) 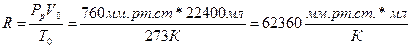
б) 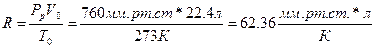
в) 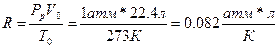
64. Газ называется идеальным, если газ подчиняется законам Клайперона-Менделеева и Рауля. Характеристика реального газа близка к идеальному, если форма его молекул близка к идеальному шару, если отсутствует взаимодействие между молекулами и столкновения молекул можно принять за упругое соударение.
65. 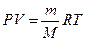 , следовательно,
, следовательно, 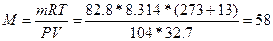 г/моль.
г/моль.
66. 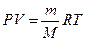 , следовательно,
, следовательно, 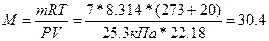 г/моль.
г/моль.
67. 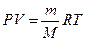 , следовательно,
, следовательно, 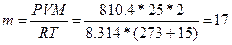 г.
г.
68. 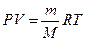 , =>
, => 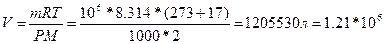 литров.
литров.
69. 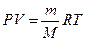 , следовательно,
, следовательно, 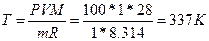
70. 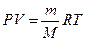 , =>
, => 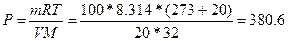 кПа
кПа
71. Уравнение Клайперона записывается: 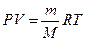 , где Р - давление, при котором находится газ, V - объем газа, m - масса газа, М - молекулярная масса газа, R - молярная газовая постоянная, Т - температура системы. Оно используется при нахождении неизвестного параметра состояния газа (давления, массы, температуры, молярной массы, объема) по известным параметрам, входящим в уравнение. Пример: найти объем 3-х моль газа, находящегося при 106.8 кПа и температуре 400К:
, где Р - давление, при котором находится газ, V - объем газа, m - масса газа, М - молекулярная масса газа, R - молярная газовая постоянная, Т - температура системы. Оно используется при нахождении неизвестного параметра состояния газа (давления, массы, температуры, молярной массы, объема) по известным параметрам, входящим в уравнение. Пример: найти объем 3-х моль газа, находящегося при 106.8 кПа и температуре 400К: 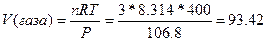 литра.
литра.
72. Нормальными условиями для газов являются 298 К, 101,3 кПа. 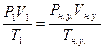 =>
=> 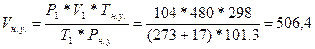 литра
литра
73. Нормальными условиями для газов являются 298 К, 101,3 кПа. 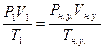 =>
=> 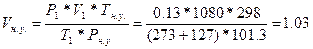 литра.
литра.
74. Парциальное давление газа пропорционально объемной доле газа в смеси газов. Р’(N2) = Р(общ)*w%(N2) / 100% = 101325*78.1 / 100 = 79135 Па. Р’(О2) = Р(общ)*w%(О2) / 100% = 101325*20.9 / 100 = 21177 Па. Р’(Ar) = Р(общ)*w%(Ar) / 100% = 101325*0.93 / 100 = 942 Па.. Р’(СО2) = Р(общ)*w%(СО2) / 100% = 101325*0.03 / 100 = 30.4 Па.
75. Парциальное давление газа пропорционально объемной доле газа в смеси газов: w%(NO) =P(NO) * 100% / P(общ) = 39990*100 / (39990 + 66630) = 37,5%; w%(NO2) =P(NO2) * 100% / P(общ) = 66630*100 / (39990 + 66630) = 62,5%;
|
|
Дата добавления: 2014-12-27; Просмотров: 422; Нарушение авторских прав?; Мы поможем в написании вашей работы!