
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стехиометрические расчеты
|
|
|
|
210.
209.
208.
207.
206.
205.
204.
203.
202.
201.
195.
| Соединение | CuO | Cu2O | (CuOH)2CO3 | CuCl42- | K2CuO2 | CuSO4*5H2O |
| Степень окисления Cu | +2 | +1 | +2 | +2 | +2 | +2 |
196. MnO2 - проявляет окислительно-восстановительную двойственность, т.к марганец находится в промежуточной степени окисления.
| MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 +H2O, Mn+4 - 2e- = Mn+6 восстановитель |
| 3MnO2 + 4Al = 2Al2O3 + 3Mn Mn+4 +24e- = Mn0 окислитель |
Mn - восстановитель, т.к. марганец находится в низшей степени окисления, может ее только повышать.
Mn + Сu(NO3)2 = Mn(NO3)2 + Cu, Mn0 - 2e- = Mn+2 восстановитель
KMnO4 - окислитель, марганец находится в высшей степени окисления.
2KMnO4 + 5NO + 3H2SO4 = 2MnSO4 + 5NO2 + K2SO4 +3H2O, Mn+6 + 4e- = Mn+2 -окислитель
197. SO2 -проявляет окислительно-восстановительную двойственность, т.к сера находится в промежуточной степени окисления.
2SO2 + O2 = 2SO3, S+4 - 2e- = S+6 восстановитель
SO2 + H2 = S + H2O, S+4 + 4e- = S0 окислитель
H2S - восстановитель, сера находится в низшей степени окисления, может ее только повышать. H2S + 4H2O2 = H2SO4 + 4H2O, S-2 -8e- = S+6
H2SO4 - окислитель, сера находится в высшей степени окисления.
2HBr + H2SO4 = Br2 + SO2 + 2H2O, S+6 + 4e- = S+2
198. KI - восстановитель, иод находится в низшей степени окисления, может ее только повышать. 2KI + H2O2 + H2SO4 = I2 + K2SO4 + 2H2O, 2I-1 -2e- = I02
HIO4 - окислитель, иод находится в высшей степени окисления, он может ее только понизить. IO -14 + 8H+ + 8e- = I-1 + 4 H2O
I2 - проявляет окислительно-восстановительную двойственность, т.к иод находится в промежуточной степени окисления, может как повысить, так и понизить ее.
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3, I02 -10e- = 2I+5 - восстановитель
I2 + NaHSO3 + H2O = 2HI + NaHSO4, I2 + 2e- = 2I-1 - окислитель
199. Pb(NO3)2 - проявляет окислительно-восстановительную двойственность, т.к свинец находится в промежуточной степени окисления, может как повысить, так и понизить ее.
Pb(NO3)2 + Ca =. Ca(NO3)2 + Pb, Pb+2 +2e- = Pb0
3Pb(NO3)2 + 8HNO3 = 3Pb(NO3)4 + 2NO +4H2O, Pb+2 -2e- = Pb+4
PbO2 - окислитель, свинец находится в высшей степени окисления, он может ее только понизить. PbO2 + SO4-2 +4H+ +2e- = PbSO4 +2H2O
Pb - восстановитель, свинец находится в низшей степени окисления, может ее только повышать. 3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO +4H2O, Pb0 -2e- = Pb+2
200. NH3 - восстановитель, азот находится в низшей степени окисления, может ее только повышать. 2 NH3 -6е- = N2 + 6H+
KNO2 - проявляет окислительно-восстановительную двойственность, т.к азот находится в промежуточной степени окисления, может как повысить, так и понизить ее.
2NO2- +4H2O +6е- = N2 + 8OH- - окислитель
NO2- + 2OH- -2е- = NO3- + H2O - восстановитель
KNO3 - окислитель, азот находится в высшей степени окисления, он может ее только понизить. 4HNO3 + 3As2O5 + 7H2O = 6H3AsO4 + 4NO, N+5 +3e- = N+2
| А) 2HBr + H2SO4 = Br2 + SO2 + 2H2O, | |
| 2Br -1 - 2e- = Br20 восстановитель S+6 + 4e- = S+2 окислитель | 2Br -1 - 2e- = Br2 SO4-2 + 4H+ + 2e- = SO2 + 2H2O |
| Межмолекулярная реакция. Мэ(HBr) = М/Э = 81/2 = 40.5г/моль, Мэ(H2SO4) = 98/2 = 49 г/моль | |
| Б) MnSO4 + Ca(ClO)2 + 4NaOH = Na2MnO4 + CaCl2 + Na2SO4 + 2H2O | |
| Mn2+ - 4e- = Mn+6 восстановитель Cl+1 + 2e- = Cl-1 окислитель | Mn2+ + 8OH- - 4e- = MnO42- + 4H2O ClO-1 + H2O + 2e- = Cl-1 + 2OH- |
| Межмолекулярная реакция. Мэ(MnSO4)= М/Э = 151/4 = 37.75 г/моль, Мэ(Ca(ClO)2) = 143/2 = 71.5 г/моль | |
| B) 5FeS + 27HNO3 = 5Fe(NO3)2 + 5H2SO4 + 9NO + 7H2O | |
| Fe+2 - 1e- = Fe+3 восстановитель N+5 + 3e- = N+2 окислитель S-2 -8e- = S+6 восстановитель | FeS +4H2O - 9e- = Fe+3 + SO4-2 + 8H+ NO3- + 6H+ + 5e- = NO + 3H2O |
| Межмолекулярная реакция. Мэ(FeS) = М/Э = 88/9 = 9.8 г/моль, Мэ(HNO3) = 63/5 = 12.6 г/моль |
| А) FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2 (SO4)3 + K2SO4 + 7H2O | |
| Fe+2 - 1e- = Fe+3 восстановитель Cr+6 +3e- = Cr+3 окислитель | Fe+2 - 1e- = Fe+3 Cr2O7 -2 + 14H+ + 6e- = 2Cr+3+ 7H2O |
| Межмолекулярная реакция. Мэ(FeSO4) = М/Э = 152/1 = 152 г/моль, Мэ(K2Cr2O7) = 294/6 = 49 г/моль | |
| Б) BiCl3 + 3SnCl2 + 18KOH = 2Bi + 3K2SnO3 + 12KCl + 9H2O | |
| Bi3+ +3e- = Bi0 восстановитель Cl+5 + 6e- = Cl-1 окислитель | Cr2O3 + 10OH- - 6e- = 2CrO42- + 5H2O MnO4- + 8H+ + 5e- = Mn2+ + 4H2O |
| Межмолекулярная реакция. Мэ(BiCl3) = М/Э = 315.5/ = 105.2 г/моль, Мэ(SnCl2) = 190/2 = 95 г/моль | |
| B) 4H2O2 + H2S = H2SO4 + 4H2O | |
| S2- - 8e- = S+6 восстановитель O- + 1e- = O-2 окислитель | H2S + 4H2O - 8e- = SO42- + 10H+ H2O2 + 2H+ + 2e- = 2H2O |
| Межмолекулярная реакция. Мэ(H2O2) = М/Э = 34/2 = 17 г/моль, Мэ(H2S) = 34/8 = 4.25 г/моль |
| А) 3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O | |
| S+4 - 2e- = S+6 восстановитель Cr+6 + 3e- = Cr+3 окислитель | SO32- + H2O - 2e- = SO42- + 2H+ Cr2O7-2 + 14H+ + 6e- = 2Cr+3 + 7H2O |
| Межмолекулярная реакция. Мэ(Na2SO3) = М/Э = 126/2 = 63 г/моль, Мэ(K2Cr2O7) = 294/6 = 49 г/моль | |
| Б) 3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O | |
| Mn4+ - 2e- = Mn+6 восстановитель Cl+5 + 6e- = Cl-1 окислитель | MnO2 + 4OH- - 2e- = MnO4-2 + 2H2O ClO3- + 3H2O + 6e- = Cl- +6OH- |
| Межмолекулярная реакция. Мэ(MnO2) = М/Э = 87/2 = 43.5 г/моль, Мэ(KClO3) = 122.5/6 = 20.4 г/моль | |
| B) 5Cl2 + I2 + 6H2O = 10HCl + 2HIO3 | |
| I2 - 10e- = 2I+5 восстановитель Cl2 + 2e- = 2Cl-1 окислитель | I2 +6H2O - 10e- = 2IO3- + 12H+ Cl2 + 2e- = 2Cl-1 |
| Межмолекулярная реакция. Мэ(I2) = М/Э = 254/10 = 25.4 г/моль, Мэ(Cl2) = 71/2 = 35.5 г/моль |
| А) 5NO + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5NO2 + K2SO4 + 3H2O | |
| N+2 - 2e- = N+4 восстановитель Mn+7 + 5e- = Mn+2 окислитель | NO + H2O - 2e- = NO2 + 2H+ MnO4- + 8H+ + 5e- = Mn+2 + 4H2O |
| Межмолекулярная реакция. Мэ(NO) = М/Э = 30/2 = 15 г/моль, Мэ(KMnO4) = 158/5 = 31.6 г/моль | |
| Б) Cr2O3 + KClO3 + 4KOH = 2K2CrO4 + KCl + 2H2O | |
| 2Cr3+ - 6e- = 2Cr+6 восстановитель Cl+5 + 6e- = Cl-1 окислитель | Cr2O3 + 10OH- - 6e- = 2CrO42- + 5H2O ClO3- + 3H2O + 6e- = Cl- + 6OH- |
| Межмолекулярная реакция. Мэ(Cr2O3) = М/Э = 152/6 = 25.3 г/моль, Мэ(KClO3) = 122.5/6 = 20.4 г/моль | |
| B) 3As2O3 + 4HNO3 + 7H2O = 6H3AsO4 + 4NO | |
| 2As+3 - 4e- = 2As+5 восстановитель N+5 + 3e- = N+2 окислитель | As2O3 +5H2O - 4e- = 2AsO43- + 10H+ NO3- + 4H+ + 3e- = NO + 2H2O |
| Межмолекулярная реакция. Мэ(As2O3) = М/Э = 198/4 = 49.5 г/моль, Мэ(HNO3) = 63/3 = 21 г/моль |
| А) 6FeSO4 + KClO3 + 3H2SO4 = 3Fe2(SO4)3 + KCl + 3H2O | |
| Fe+2 - 1e- = Fe+3 восстановитель Cl+5 + 6e- = Cl- окислитель | Fe+2 - 1e- = Fe+3 ClO3- + 6H+ + 6e- = Cl- + 3H2O |
| Межмолекулярная реакция. Мэ(FeSO4) = М/Э = 152/1 = 152 г/моль, Мэ(KClO3) = 122.5/6 = 20.4 г/моль | |
| Б) MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 + H2O | |
| Mn+4 - 2e- = Mn+6 восстановитель N+5 + 2e- = N+3 окислитель | MnO2 + 4OH- - 2e- = MnO42- + 2H2O NO3- + H2O + 2e- = NO2- + 2OH- |
| Межмолекулярная реакция. Мэ(MnO2) = М/Э = 87/2 = 43.5 г/моль, Мэ(KNO3) = 101/2 = 50.5 г/моль | |
| B) 4Cd + 10HNO3 = 4Cd(NO3)2 + N2O + 5H2O | |
| Cd0 - 2e- = Cd+2 восстановитель N+5 + 4e- = N+1 окислитель | Cd0 - 2e- = Cd+2 2NO3- + 10H+ + 8e- = N2O + 5H2O |
| Межмолекулярная реакция. Мэ(Cd) = М/Э = 112/2 = 56 г/моль, Мэ(HNO3) = 63/8 = 7.9 г/моль |
| А) 3SnCl2 + K2Cr2O7 + 7H2SO4 = 3Sn(SO4)2 + 2CrCl3 + K2SO4 + 7H2O | |
| Sn+2 - 2e- = Sn+4 восстановитель Cr+6 + 3e- = Cr+3 окислитель | Sn+2 - 2e- = Sn+4 Cr2O7-2 + 14H+ + 6e- = 2Cr+3 + 7H2O |
| Межмолекулярная реакция. Мэ(SnCl2) = М/Э = 190/2 = 95 г/моль, Мэ(K2Cr2O7) = 294/6 = 49 г/моль | |
| Б) 3Sb2O3 + 4HNO3 + 7H2O = 6H3SbO4 + 4NO | |
| 2Sb+3 - 4e- = 2Sb+5 восстановитель N+5 + 3e- = N+2 окислитель | Sb2O3 + 5H2O -4e- = 2SbO43- + 10H+ NO3- + 4H+ +3e- = NO + 2H2O |
| Межмолекулярная реакция. Мэ(Sb2O3) = М/Э = 292/4 = 73 г/моль, Мэ(HNO3) = 63/3 = 21 г/моль | |
| B) I2 + 5H2O2 = 4H2O + 2HIO3 | |
| I2 - 10e- = 2I+5 восстановитель O-1 + 1e- = O-2 окислитель | I2 +6H2O - 10e- = 2IO3- + 12H+ H2O2 + 2H+ +2e- = 2H2O |
| Межмолекулярная реакция. Мэ(I2) = М/Э = 254/10 = 25.4 г/моль, Мэ(H2O2) = 34/2 = 17 г/моль |
| А) 2HBr + 7H2SO4 = Br2 + SO2 + 2H2O | |
| 2Br-1 - 2e- = Br2 восстановитель S+6 + 2e- = S+4 окислитель | 2Br -1 - 2e- = Br2 SO4-2 + 4H+ + 2e- = SO2 + 2H2O |
| Межмолекулярная реакция. Мэ(HBr) = М/Э = 81/2 = 40.5г/моль, Мэ(H2SO4) = 98/2 = 49 г/моль | |
| Б) 5FeCl2 + KMnO4 + 8HCl = 5FeCl3 + MnCl2 + KCl +4H2O | |
| Fe+2 - 1e- = Fe+3 восстановитель Mn+7 + 5e- = Mn+2 окислитель | Fe+2 - 1e- = Fe+3 MnO4- + 8H+ + 5e- = Mn2+ + 4H2O |
| Межмолекулярная реакция. Мэ(FeCl2) = М/Э = 127/1 = 127 г/моль, Мэ(KMnO4) = 158/5 = 31.6 г/моль | |
| B) Sb2O3 + Br2 + 10NaOH = 2Na3SbO4 + 4NaBr +5H2O | |
| 2Sb+3 - 4e- = 2Sb+5 восстановитель Br2 +2e- = 2Br -1 окислитель | Sb2O3 + 10OH- - 4e- = 2SbO43- + 5 H2O Br2 +2e- = 2Br -1 |
| Межмолекулярная реакция. Мэ(Br2) = М/Э = 160/2 = 80 г/моль, Мэ(Sb2O3) = 292/4 = 73 г/моль |
| А) 2NaI + 2NaNO2 + 2H2SO4 = I2 + 2NO + 2Na2SO4 + 2H2O | |
| 2I- - 2e- = I2 восстановитель N+3 + 1e- = N+2 окислитель | 2I- - 2e- = I2 NO2- + 2H+ + 1e- = NO + H2O |
| Межмолекулярная реакция. Мэ(NaI) = М/Э = 150/2 = 75 г/моль, Мэ(NaNO2) = 69/1 = 69 г/моль | |
| Б) 2Bi(NO3)3 + 3SnCl2 + 18NaOH = 2Bi + 3Na2SnO3 + 3NaNO3 + 6NaCl + 9H2O | |
| Bi3+ + 3e- = Bi0 окислитель Sn+2 - 2e- = Sn+4 восстановитель | Bi3+ + 3e- = Bi0 Sn+2 + 6OH- - 2e- = SnO32- + 3H2O |
| Межмолекулярная реакция. Мэ(Bi(NO3)3) = М/Э = 395/3 = 131.7 г/моль, Мэ(SnCl2) = 190/2 = 95 г/моль | |
| B) 5Zn + 12HNO3 = 5Zn(NO3)2 + N2 + 6H2O | |
| Zn0 - 2e- = Zn+2 восстановитель 2N+5 +10e- = N20 окислитель | Zn0 - 2e- = Zn+2 2NO3- + 12H+ + 10e- = N2 + 6H2O |
| Межмолекулярная реакция. Мэ(Zn) = М/Э = 65.4/2 = 32.7 г/моль, Мэ(HNO3) = 63/10 = 6.3 г/моль |
| А) CuS + 10HNO3 = Cu(NO3)2 + H2SO4 + 8NO2 + 2H2O | |
| S2- - 8e- = S+6 восстановитель N+5 + 1e- = N+4 окислитель | S2- + 4H2O - 8e- = SO42- + 8H+ NO3- + 2H+ + 1e- = NO2 + H2O |
| Межмолекулярная реакция. Мэ(CuS) = М/Э = 96/8 = 12 г/моль, Мэ(HNO3) = 63/1 = 69 г/моль | |
| Б) Cl2 + NaHSO3 + H2O = 2HCl + NaHSO4, | |
| Cl2 + 2e- = 2Cl-1 - окислитель S+4 - 2e- = S+6 восстановитель | Cl2 + 2e- = 2Cl-1 HSO3- + H2O - 2e- = HSO4- + 2H+ |
| Межмолекулярная реакция. Мэ(Cl2) = М/Э = 71/2 = 35.5 г/моль, Мэ(NaHSO3) = 104/2 = 52 г/моль | |
| B) Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 +2H2O | |
| 2Fe3+ - 6e- = 2Fe+6 восстановитель N+5 +2e- = N+3 окислитель | Fe2O3 + 10OH- - 6e- = 2FeO4-2 + 5H2O NO3- + H2O + 2e- = NO2- + 2OH- |
| Межмолекулярная реакция. Мэ(Fe2O3) = М/Э = 160/6 = 26.7 г/моль, Мэ(KNO3) = 101/2 = 50.5 г/моль |
| А) Cr2(SO4)3 + 3NaClO + 10KOH = 2K2CrO4 + 3NaCl + K2SO4 + 5H2O | |
| Cr3+ - 3e- = Cr+6 восстановитель Cl+1 + 2e- = Cl-1 окислитель | Cr3+ + 8OH- - 3e- = CrO42- + 4H2O ClO- + H2O + 2e- = Cl- + 2OH- |
| Межмолекулярная реакция. Мэ(Cr2(SO4)3) = М/Э = 392/3 = 130.7 г/моль, Мэ(NaClO) = 83.5/2 = 41.8 г/моль | |
| Б) 5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O | |
| S4+ - 2e- = S+6 восстановитель Mn+7 + 5e- = Mn+2 окислитель | SO32- + H2O - 2e- = SO42- + 2H+ MnO4- + 8H+ + 5e- = Mn2+ + 4H2O |
| Межмолекулярная реакция. Мэ(Na2SO3) = М/Э = 144/2 = 72 г/моль, Мэ(KMnO4) = 158/5 = 31.6 г/моль | |
| B) 2KI + H2O2 + H2SO4 = I2 + K2SO4 + 2H2O | |
| 2I- - 2e- = I2 восстановитель O- + 1e- = O2- окислитель | 2I- - 2e- = I2 H2O2 + 2H+ + 2e- = 2H2O |
| Межмолекулярная реакция. Мэ(KI) = М/Э = 166/2 = 83 г/моль, Мэ(H2O2) = 34/2 = 17 г/моль |
211. а) FeO - возьмем 1 моль оксида, тогда его масса m(FeO) = n*M = 1*72 = 72 г. Содержание железа и кислорода в оксиде n(Fe) = n(O) = 1 моль.
m(Fe) = n*M = 1*56 = 56 г. w%(Fe) = m(Fe)*100%/m(FeO) = 56*100%/72 = 77.78 %
m(O) = n*M = 1*16 = 16 г. w%(O) = m(O)*100%/m(FeO) = 16*100%/72 = 22.22 %
б) Fe2O3- возьмем 1 моль оксида, тогда его масса m(Fe2O3) = n*M = 1*160 = 160 г. Содержание железа и кислорода в оксиде n(Fe) = 2 моль, n(O) = 3 моль.
m(Fe) = n*M = 2*56 = 112 г. w%(Fe) = m(Fe)*100%/m(Fe2O3) = 112*100%/160 = 70%
m(O) = n*M = 3*16 = 48 г. w%(O) = m(O)*100%/m(Fe2O3) = 48*100%/160 = 30%
212. KMnO4 - возьмем 1 моль соли, тогда её масса m(KMnO4) = n*M = 1*158 = 158 г. Содержание калия, марганца и кислорода: n(K) = 1 моль, n(Mn) = 1 моль, n(O) = 4 моль.
m(K) = n*M = 1*39=39 г. w%(K) = m(K)*100%/m(KMnO4) = 39*100%/158 = 24.7%
m(Mn) = n*M = 1*55 = 55 г. w%(Mn) = m(Mn)*100%/m(KMnO4) = 55*100%/158 = 34.8%
m(O) = n*M = 4*16 = 64 г. w%(O) = m(O)*100%/m(KMnO4) = 64*100%/158 = 40.5%
213. а) NH3 - возьмем 1 моль аммиака, тогда его масса m(NH3)=n*M=1*17=17 г. Содержание азота и водорода: n(N)=1 моль, n(H)=3 моль.
m(N)=n*M=1*14=14 г. w%(N)=m(N)*100%/m(NH3) =14*100%/17=82.4%
m(H)=n*M=3*1=3 г. w%(H)=m(H)*100%/m(NH3) =3*100%/17=17.6%
а) N2H4 - возьмем 1 моль гидразина, тогда его масса m(N2H4)=n*M=1*30=30 г. Содержание азота и водорода: n(N)=2 моль, n(H)=4 моль.
m(N)=n*M=1*14=14 г. w%(N)=m(N)*100%/m(NH3) =14*100%/17=82.4%
m(H)=n*M=3*1=3 г. w%(H)=m(H)*100%/m(NH3) =3*100%/17=17.6%
214. Сульфат натрия Na2SO4. Возьмем один моль соли. В одном моль соли содержится 2 моль натрия, один моль серы и 4 моль кислорода.
m(Na2SO4)=n*M=1*142=142 г.
m(Na)=n*M=2*23=46 г. w%(Na) = m(Na)*100%/m(Na2SO4) = 46*100/142 = 32.4 %
m(S)=n*M=1*32=32 г. w%(S) = m(S)*100%/m(Na2SO4) = 32*100/142 = 22.5 %
m(O)=n*M=4*16=64 г. w%(O) = m(O)*100%/m(Na2SO4) = 64*100/142 = 45.1 %
215. Обезвоженные хромокалиевые квасцы: KCr(SO4)2 Возьмем один моль соли. В одном моль соли содержится 1 моль калия, 1 хрома, 2 моль серы и 8 моль кислорода.
m(KCr(SO4)2)=n*M=1*283=283 г.
m(K)=n*M=1*39=39 г. w%(K) = m(K)*100%/m(KCr(SO4)) = 39*100/283 = 13.8 %
m(Cr)=n*M=1*52=52 г. w%(Cr) = m(Cr)*100%/m(KCr(SO4)) = 52*100/283 = 18.4 %
m(S)=n*M=2*32=64 г. w%(S) = m(S)*100%/m(KCr(SO4)) = 64*100/283 = 22.6 %
m(O)=n*M=8*16=128 г. w%(O) = m(O)*100%/m(KCr(SO4)) = 128*100/283 = 45.2 %
216. w%(H) = 5.882 %, w%(O) = 100-5.882 = 94.118 %. Dвоздуху = 1.1724. Молярная масса вещества равна: M(HxOy) = Dвоздуху*M(воздуха) = 1.1724*29 = 34 г/моль. Возьмем один моль вещества: его масса равна 34 грамма, следовательно -
m(H) = 34*5.882%/100% = 2 г. n(H) = m/M = 2/1 = 2 моль.
m(О) = 34*94.118%/100% = 32 г. n(О) = m/M = 32/16 = 2 моль. Следовательно, это Н2О2.
217. w%(As) = 75.76 %, w%(O) = 100-75.76 = 24.24 %. Dвоздуху = 13.65. Молярная масса вещества равна: M(AsxOy) = Dвоздуху*M(воздуха) = 13.65*29 = 395.85 г/моль. Возьмем один моль вещества: его масса равна 395.85 грамма, следовательно -
m(As) = 395.85*75.76%/100% = 300 г. n(As) = m/M = 300/75 = 4 моль.
m(О) = 395.85*24.24%/100% = 96 г. n(О) = m/M = 96/16 = 6 моль.
Следовательно, это As4О6.
218. w%(B) = 78.2 %, w%(H) = 100-78.2 = 21.8 %. Так как масса одного литра этого газа равна массе одного литра азота, то молекулярные массы этих газов также равны: M(BxHy) = M(N2) = 28 г/моль. Возьмем один моль BxHy: его масса равна 28 г., следовательно -
m(B) = 28*78.2%/100% = 22 г. n(B) = m/M = 22/11 = 2 моль.
m(H) = 28*21.8%/100% = 6 г. n(H) = m/M = 6/1 = 6 моль.
Следовательно, это B2H6.
219. w%(C) = 80 %, w%(H) = 20 %. DH = 15. Молярная масса вещества равна: M(CxHy) = DH*M(H2) = 15*2 = 30 г/моль. Возьмем один моль вещества: его масса равна 30 грамм, следовательно -
m(C) = 30*80%/100% = 24 г. n(C) = m/M = 24/12 = 2 моль.
m(H) = 30*20%/100% = 6 г. n(H) = m/M = 6/1 = 6 моль.
Следовательно, это C2H6.
220. w%(C) = 92.3 %, w%(H) = 7.7 %.
V = 1л, m = 1.17г, M(CxHy) = m/n = m*Vм/V = 1.17*22.4/1 = 26 г/моль.
Возьмем один моль вещества: его масса равна 26 грамм, следовательно -
m(C) = 26*92.3%/100% = 24 г. n(C) = m/M = 24/12 = 2 моль.
m(H) = 26*7.7%/100% = 2 г. n(H) = m/M = 2/1 = 2 моль.
Следовательно, это C2H2.
б) V = 1л, m = 3.51г, M(CxHy) = m/n = m*Vм/V = 3.51*22.4/1 = 78 г/моль.
Возьмем один моль вещества: его масса равна 26 грамм, следовательно -
m(C) = 78*92.3%/100% = 72 г. n(C) = m/M = 72/12 = 6 моль.
m(H) = 78*7.7%/100% = 6 г. n(H) = m/M = 6/1 = 6 моль.
Следовательно, это C6H6.
221. CaCO3 = CaO + CO2. m(CaO) = 280 кг. n(CaO) = m/M = 280000/56 = 5000 моль. Согласно уравнению реакции, n(CaCO3) = n(CaO) = 5000 моль. m(CaCO3) = n*M=5000*100= 500кг.
222. CaCO3.MgCO3 = CaO + MgO + 2CO2. m(доломита) = 920г. n(доломита) = m/M = 920/184 = 5 моль. Согласно уравнению реакции, n(CO2) = 2n(доломита) = 2*5 = 10 моль. V(CO2) = Vм(CO2)*n(CO2) = 22.4*10 = 224 литра.
223. FeS + 2HCl = FeCl2 + H2S; 2H2S + 3O2 = 2SO2 + 2H2O
V(O2) = 306л., n(O2) = V/Vм = 306/22.4 = 13.66моль. n(H2S) = 2/3n(O2) = 9.11моль. n(FeS) = n(H2S). m(FeS) = n*M = 9.11*88 = 801г.
224. Zn + 2HCl = ZnCl2 + H2 V(H2) = 280мл. n(H2) = V/Vм = 0.28/22.4 = 0.0125моль. Согласно уравнению реакции, n(Zn) = n(ZnCl2) = n(H2). Масса израсходованного цинка - m(Zn) = n*M = 0.0125*65.4 = 0.8175г. Масса образовавшегося хлорида цинка - m(ZnCl2) = n*M = 0.0125*136 = 1.7г.
225. BaCl2 + 2AgNO3 = Ba(NO3)2 + 2AgCl. m(AgCl) = 287г. n(AgCl) = m/M = 287/143.5 = 2моль. Согласно уравнению реакции, n(AgNO3) = n(AgCl), следовательно, m(AgNO3) = n*M = 2*170 = 340г.
226. KOH + HNO3 = KNO3 + H2O. m(KOH) = 10г. - n(KOH) = m/M = 10/56 = 0.18моль, m(HNO3) = 10г. - n(HNO3) = m/M = 10/63 = 0.16моль. В избытке находится гидроксид калия, nизб(KOH) = 0.18 - 0.16 = 0.02моль. mизб(KOH) = nизб*M = 0.02*56 = 1.12г.
227. 2NaOH + H2SO4 = Na2SO4 + 2H2O. m(NaOH) = 9г. n(NaOH) = m/M = 9/40 = 0.225моль. m(H2SO4) = 10г. n(H2SO4)= m/M = 10/98 = 0.102моль. На реакцию с 0.102 моль серной кислоты, согласно уравнению реакции, требуется 2*0.102 = 0.204 моль NaOH. Следовательно в избытке находится щелочь, и среда раствора будет щелочной.
228. HCl + NH3 = NH4Cl. m(HCl) = 7.3; n(HCl) = m/M = 7.3/36.5 = 0.2моль. m(NH3) = 4.0г. n(NH3) = m/M = 4/17 = 0.24г. Согласно уравнению реакции, вещества реагируют в равных количествах, следовательно, в избытке находится аммиак. n(HCl) = n(NH4Cl). m(NH4Cl) = n*M = 0.2*53.5 = 10.7г.
Не прореагировало 0.24-0.2 = 0.04 моль аммиака - m(NH3) = n*M = 0.04*17 = 0.68г.
229. FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl. Согласно уравнению реакции, вещества реагируют в соотношении 1 к 3, следовательно, с 0.20 моль хлорида железа будет взаимодействовать 3*0.2 = 0.6 моль щелочи. Щелочь находится в недостатке. Израсходуется 0.24/3 = 0.08 моль FeCl3 и образуется такое же количество Fe(OH)3. Останется 0.2 - 0.08 = 0.12 моль FeCl3.
230. S + O2 = SO2. m(S) = 8 г. n(S) = m/M = 8/32 = 0.25 моль. V(O2) = 30 литров. n(O2) = V/Vм = 30/22.4 = 1.14 моль. Из уравнения реакции видно, что сера находится в недостатке. После реакции останется кислород в количестве 1.14 - 0.25 = 0.89 моль. V(O2) = n*Vм = 0.89*22.4 = 20 литров.
231. CaCO3 + 2HCl = CaCl2 + CO2 + H2O. V(CO2) = 571.2л. n(CO2) = V/Vм = 571.2/22.4 = 25.5 моль. Согласно уравнению реакции, n(CaCO3) = n(CO2). m(CaCO3) = n*M = 25.5*100 = 2550 г. С учетом примесей масса известняка будет равна 2550*100%/85% = 3000 г.
232. m(Fe2O3) = 2т. Масса чистого оксида составляет m = 2000000*94%/100% = 1880000 г. n(Fe2O3) = m/M = 1880000/160 = 11750 моль. Из одного моль оксида можно получить два моль железа. m(Fe) = 2*n(Fe2O3)*M(Fe) = 2*11750*56 = 1316000 = 1,32 тонны.
233. Объем смеси 1 м3.
V(H2) = 1*50%/100% = 0.5 м3, n(H2) = V/Vм = 0.5*103/22.4 = 22.3 моль.
V(СH4) = 1*35%/100% = 0.35 м3, n(СH4) = V/Vм = 0.35*103/22.4 = 15.6 моль.
V(СО) = 1*8%/100% = 0.08 м3, n(СО) = V/Vм = 0.08*103/22.4 = 3.6 моль.
V(С2H4) = 1*2%/100% = 0.02 м3, n(С2H4) = V/Vм = 0.02*103/22.4 = 0.9 моль.
H2 + O2 = 2H2O На сжигание водорода потребуется n(O2)= 1/2n(H2) = 22.3/2 = 11.15 моль
СH4 + 2O2 = 2H2O+ СO2 На сжигание метана потребуется n(O2)= 2n(СH4) = 15.6*2 = 31.2 моль
2СО + O2 = 2СО2 На сжигание СО потребуется n(O2)= 1/2n(СО) = 3.6/2 = 1.8 моль
С2H4 + 3O2 = 2H2O + 2СО2 На сжигание С2Н4 потребуется n(O2)= 3n(С2H4) = 0.9*3 = 2.7 моль
Всего будет затрачено 11.15 + 31.2 + 1.8 + 2.7 = 46.85 моль кислорода. V(O2) = n*Vм = 46.85*22.4 = 1049.44 литров. V(воздуха) = V(O2)*100%/21% = 4997.3 литров = 5м3.
234. FeS + 2HCl = FeCl2 + H2S. m(FeS) = 500г. n(FeS) = m/M = 500/88 = 5.7 моль. Согласно уравнению реакции из 5.7 моль сульфида железа можно получить 5.7 моль сероводорода. Однако, образовалось n(H2S) = V/Vм = 112/22.4 = 5 моль. Выход реакции В = 5*100%/5.7 = 87.7%.
235. 3О2 = 2О3. В 100 литрах воздуха содержится V(O2) = 100*21%/100% = 21 литр. n(O2) = V/Vи = 21/22.4 = 0.9375 моль. Согласно уравнению реакции, n(O3) = 2/3n(O2) = 2*0.9735/3 = 0.625 моль. V(O3) = 0.625*22.4 = 14 литров. Выход реакции равен В = 1.4*100%/14 = 10%.
236. Zn + 2H+ = Zn2+ + H2. n(H2) = 6.272/22.4 = 0.28 моль. Согласно уравнению реакции, n(Zn) = n(H2). Масса чистого цинка равна m(Zn) = n*M = 0.28 * 65.4 = 18.3 г. Масса примесей в цинке m = 20.4 - 18.3 = 2.1. Следовательно, содержание примесей w%(примесей) = 2.1*100%/20.4 = 10.3%.
237. С + О2 = СО2. n(CO2) = V/Vм = 5.3*103/22.4 = 236.6 моль. Согласно уравнению реакции, n(С) = n(СО2). Масса чистого углерода m(С) = n*M = 236.6*12 = 2,84 кг. Содержание углерода в угле w%(C) = 2.84*100%/3 = 95%.
238. CaCO3*MgCO3 = CaO + MgO + 2CO2. n(СО2) = V/Vм = 21/22.4 = 0.9375 моль. Согласно уравнению реакции, n(доломита) = 1/2n(CO)2 = 0.9375/2 = 0.469 моль. m(доломита) = n*M = 0.469*184 = 86.25 г. Масса примесей в доломите составляет m = 100 - 86.25 = 13.75 г. w%(примесей) = 13.75*100%/100 = 13.75%.
239. 4FeS2 + 11O2 = 2Fe2O3 + 8SO2. Найдем количество образовавшегося сернистого газа: n(SO2) = V/Vм = 3500*103/22.4 = 156250 моль. Согласно уравнению реакции, n(FeS2) = 1/2n(SO2) = 156250/2 = 78125 моль. m(FeS2) = n*M = 78125*120 = 9375 кг = 9.4 тонн. Содержание пирита в руде - w%(FeS2) = 9.4*100%/100 = 9.4%.
240. Обозначим массу алюминия - х, массу магния - у. х + у =12 г. Уравнение Менделеева-Клайперона: 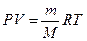 . Количество выделившегося водорода равно: n(H2) = PV/RT = 100.7*14.4/(8.31*(23+273)) = 0.6 моль.
. Количество выделившегося водорода равно: n(H2) = PV/RT = 100.7*14.4/(8.31*(23+273)) = 0.6 моль.
Mg + 2HCl = MgCl2 + H2. n1(H2) = n(Mg) m/M = y/24
2Al + 6HCl = 2AlCl3 + 3H2. n2(H2) = 3/2n(Al) = m/M = x/27
y/24 + x/27 = 0.6 (y = 12 - x), следовательно, (12 - х)/24 + х/27 = 0.6, откуда х=5.9. m(Mg) = 5.9 г. m(Al) = 12 - 5.9 = 6.1 г. Содержание металлов в сплаве равно: w%(Mg) = 5.9*100%/12 = 49.1%, w%(Al) = 100% - 49.2% = 50.2%.
241. Стандартной энтальпией образования (∆Hof) называют тепловой реакции образования одного моля химического соединения из простых веществ, устойчивых при данных условиях. S + O2 = SO2. n(S) = m/M = 10/32 = 0.3125 моль.
∆Hof(SO2) = -Q/n = 92.8/0.3125 = -296.96 кДж/моль. Справочное значение -296.9 кДж/моль
242. Н2 + 1/2О2 = Н2О. n(Н2) = V/Vм = 2.24/22.4 = 0.1 моль. ∆Hof(Н2О) = -Q/n = 28.6/0.1 = -286 кДж/моль. Образовалась вода в жидком состоянии.
243. Ca + F2 = CaF2. n(Са) = m/M = 2/40 = 0.05 моль.
∆Hof(CaF2) = -Q/n = 61/0.05 = 1220 кДж/моль. Ошибка опыта равна (1220-1214.6)/1214.6 = 0.0044 = 0.44%
244. 2Al + 3/2O2 = Al2O3. ∆Hof(Al2О3) = -Q/n, следовательно, n(Al2O3) = 1676/838 = 2 моль. Согласно уравнению реакции, n(Al) = 2n(Al2O3) = 4 моль, n(O2) = 3/2n(Al2O3) = 3 моль. m(Al) = n*M = 4*27 = 108 г. V(O2) = 3*22.4 = 67.2 л.
245. Ca + 1/2O2 = CaO + Q. Q = - ∆Hof * n. ∆Hof(CaO) = -635.5 кДж/моль. n(Ca) = m/M = 200/40 = 5 моль. Q = 635.5*5 = 3177.5 кДж.
246. H2 + Br2 = 2HBr + Q. Q = - ∆Hof * n. ∆Hof(HBr) = -36.3 кДж/моль. n(H2) = V/Vм = 560/22.4 = 25 моль. n(Br2) = m/M = 500/80 = 6.25 моль. Бром находится в недостатке, поэтому расчет ведем по брому: Q = 36.3*6.25 = 227 кДж.
247. Закон Лавуазье-Лапласа: тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Например: Тепловой эффект реакции CaCO3 = CaO + CO2 запишется как ∆HoР = ∆Ho(CaO) + ∆Ho(CO2) - ∆Ho(CaCO3) = -635.5 - 393.5 + 1206.9 = 177.9 кДж/моль. Закон Лавуазье-Лапласа следует из закона Гесса (тепловой эффект реакции зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий), поэтому его называют следствием закона Гесса.
248. CuO = Cu + 1/2O2 - Q. ∆Hof = -Q/n. Q = 12.8 кДж. n(Cu) = m/M =5/64 = 0.078 моль. ∆Hof(CuO) = -12.8/0.078 = -163.8 кДж/моль. Справочное значение: -162 кДж/моль.
249. Cu2O = 2Cu + 1/2O2 - Q. ∆Hof = - Q / n. Q = 17 кДж. n(Cu) = m/M =12.7/64 = 0.2 моль. ∆Hof(Cu2O) = - 2*17 / 0.2 = -171.3 кДж/моль. Справочное значение: -173.2 кДж/моль.
250. CaH2 = Ca + H2 - Q. ∆Hof = - Q / n. Q = 23.6 кДж. V(H2) = V/Vм =2.8/22.4 = 0.125 моль. ∆Hof(CaH2) = - 23.6 / 0.125 = -188.8 кДж/моль. Справочное значение: -188.7 кДж/моль.
251. 1. Са(ОН)2 = СаО + Н2О ∆H01 = 65.3 кДж/моль
2. Ca(OH)2 + SiO2 = CaSiO3 + H2O ∆H02 = -23.3 кДж
3. CaO + SiO2 ∆H03 =?
∆H03 = ∆H02 - ∆H01 = -23.3 – 65.3 = -233.6 кДж.
Закон Гесса: сумма энтальпий двух или более промежуточных реакций при переходе из исходного к конечному состоянию равна энтальпии реакции, которая ведет от исходного к конечному состоянию непосредственно.
1 следствие: теплота образования реакции равна разности между суммой теплот образования продуктов и суммой теплот образования исходных веществ.
2 следствие: теплота сгорания – тепловой эффект реакции сгорания одного моль вещества.
3 следствие: если совершается 2 реакции, приводящие из разных начальных состояний к равным конечным, то разница между их тепловыми эффектами есть тепловой эффект перехода из одного состояния в другое
252. Термохимические уравнения - уравнения, в которых приведены значения энтальпий данной реакции и указаны абсолютные состояния реагентов и продуктов. На основании закона Гесса с термохимическими уравнениями можно оперировать, как и с алгебраическими.
1. H2S + 3/2O2 = H2O + SO2 ∆H01 = -561.1 кДж
2. S + O2 = SO2 ∆H02 = -296.2 кДж
3. 2H2S + SO2 = 3S + 2H2O ∆H03 =?
∆H03 = 2∆H01 - 3∆H02 = 2*(-561.1) - 3(-296.2) = -233.6 кДж.
253. а) 2As(к) + 3F2(г) = 2AsF3(г), ∆H01 = -1842 кДж
б) AsF5(г) = AsF3(г) + F2(г), ∆H02 = 317 кДж
в) 2As(к) + 5F2(г) = 2AsF5(г), ∆H03 =?
∆H03 = ∆H01 - 2∆H02 = -1842 - 2*317 = -2476 кДж.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 505; Нарушение авторских прав?; Мы поможем в написании вашей работы!