
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория гибридизации и ОЭПВО 2 страница
|
|
|
|
413. Сродством к электрону называется энергия, выделяющаяся при присоединении электрона к электронейтральному атому. С ростом порядкового номера элемента сродство к электрону по периодам растет, а по группам уменьшается. Минимальное сродство к электрону имеют щелочные металлы и благородные газы. Максимальное сродство к электрону у галогенов.
414. Относительная электроотрицательность (ОЭО) - условная оценка способности атома данного элемента оттягивать на себя электронную плотность по сравнению с атомами других элементов в соединении. С ростом порядкового номера элемента ОЭО по периодам растет, а по группам уменьшается. Минимальную ОЭО имеет франций, а максимальная ОЭО у атома фтора.
415. Максимальная валентность химических элементов зависит то количества внешних электронов. По периоду число валентных электронов растет - соответственно увеличивается максимальная валентность. По группам значение максимальной валентности не изменяется, т.к. не добавляется валентные электроны.
416. Если иметь в виду только s- и p-элементы, то для их оксидов по группам сверху вниз и по периодам справа налево усиливаются основные свойства и ослабевают кислотные свойства. Это происходит вследствие соответствующего изменения радиусов атомов центральных элементов в оксидах: чем больше радиус элемента, тем сильнее выражены его металлические свойства, тем более основными свойствами обладает его оксид.
Пример №1 (по третьему периоду):
Na2O + 2HCl = 2NaCl + H2O; Na2O + KOH = реакция не протекает.
Al2O3 + 6HCl = 2AlCl3 + 3H2O; Al2O3 + 6KOH =2K3AlO3 + 3H2O
Cl2O7 + HCl = реакция не протекает; Cl2O7 + 2KOH = 2KClO4 + H2O.
Пример №2 (по третьей группе):
B2O3 + HCl = реакция не протекает; B2O3 + 6KOH = 2K3BO3 + 3H2O.
Al2O3 + 6HCl = 2AlCl3 + 3H2O; Al2O3 + 6KOH =2K3AlO3 + 3H2O
In2O3 + 6HCl = 2InCl3 + 3H2O; In2O3 + KOH = реакция не протекает.
417. Если иметь в виду только s- и p-элементы, то для их гидроксидов по группам сверху вниз и по периодам справа налево усиливаются основные свойства и ослабевают кислотные свойства. Это происходит вследствие соответствующего изменения радиусов атомов центральных элементов в оксидах: чем больше радиус элемента, тем сильнее выражены его металлические свойства, тем более основными свойствами обладает его гидроксид.
Пример №1 (по третьему периоду):
NaOH + HCl = NaCl + H2O; NaOH + KOH = реакция не протекает
Al(OH)3 + 3HCl = AlCl3 + 3H2O; Al(OH)3 + 3KOH =K3[Al(OH)6]
HClO4 + HCl = реакция не протекает; HClO4 + KOH = KClO4 + H2O
Пример №2 (по третьей группе):
B(OH)3 + HCl = реакция не протекает; B(OH)3 + 3KOH = K3BO3 + 3H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O; Al(OH)3 + 3KOH =K3[Al(OH)6]
In(OH)3 + 3HCl = InCl3 + 3H2O; In(OH)3 + KOH = реакция не протекает.
Э2O3 + 6HCl = 2ЭCl3 + 3H2O.
418. При переходе от одного периода к другому свойства оксидов и гидроксидов d-элементов меняются незначительно, либо остаются практически неизменными. Так, в ряду оксидов и гидроксидов скандия - иттрия - лютеция наблюдаются осн о вные свойства: Э2О3 + КОН = реакция не протекает. У соответствующих соединений цинка - кадмия - ртути свойства изменяются от амфотерных до осн о вных. В HCl = реакция не протекает; Э2O7 + 2KOH = 2KЭO4 + H2O.
419. Диагональным сходством называется сходные свойства элементов находящихся на одной ряду оксидов и гидроксидов марганца - технеция - рения наблюдаются кислотные свойства: Э2O7 + диагонали в периодической таблице. Причиной этого эффекта является приблизительное равенство радиусов атомов соответствующих элементов. Примером диагонального сходства может служить идентичность некоторых свойств лития и магния: металлы, относительно хорошие комплексообразователи, образуют одинаково белые соли со значительной степенью ионности связи и т.п.
420. Полными электронными аналогами называются элементы, которые в любой степени окисления имеют подобную структуру внешнего и предвнешнего электронного уровня. Неполные электронные аналоги имеют подобную структуру внешнего и предвнешнего электронного уровня только в максимальной степени окисления. Сходство: в максимальной степени окисления полные и неполные электронные аналоги образуют химические соединения подобного стехиометрического состава. Эти соединения имеют схожие химические свойства (кислотность, основность, активность). В промежуточных степенях окисления полные и неполные электронные аналоги образуют сильно отличающиеся друг от друга соединения.
Химические элементы называются типическими, если они обладают свойствами, позволяющими отнести их только к какому-либо одному классу элементов. Именно отсутствие двойственности свойств, амфотерности отличает типические элементы от нетипических.
421. Связь называется ковалентной неполярной, если она осуществляется между атомами с одинаковой относительной электроотрицательностью (ОЭО). Если ОЭО атомов, образующих связь различается менее, чем на 2.1, то такая связь называется ковалентной полярной. В случае, если разница в ОЭО больше, чем 2.1, то связь называется ионной. Связь, образованная атомами металлов называется металлической.
| Азот (N2) | Ковалентная неполярная |
| Железо (Fe) | Металлическая |
| Углекислый газ (CO2) | Ковалентная полярная |
| Фторид калия (KF) | Ионная |
| Фосфин (PH3) | Ковалентная полярная |
| Сульфат натрия (Na2SO4) | Ионная + полярная |
| Кремний (Si) | Неполярная |
422. Связь называется ковалентной неполярной, если она осуществляется между атомами с одинаковой относительной электроотрицательностью (ОЭО). Если ОЭО атомов, образующих связь различается менее, чем на 2.1, то такая связь называется ковалентной полярной. В случае, если разница в ОЭО больше, чем 2.1, то связь называется ионной. Связь, образованная атомами металлов называется металлической.
| Иодоводород (HI) | Ковалентная полярная |
| Никель (Ni) | Металлическая |
| Оксид кремния (SiO2) | Ковалентная полярная |
| Оксид магния (MgO) | Ковалентная полярная |
| Нитрат калия (KNO3) | Ионная + полярная |
| Фтор (F2) | Ковалентная неполярная |
423. Химическая связь - взаимодействие атомов, обусловливающее образование химически устойчивой двух- или многоатомной системы. Три основные типа химической связи: ковалентная, ионная, металлическая.
| Тип химической связи | Атомы каких элементов вступают в связь | Процессы в электронных оболочках атомов | Образующиеся частицы и вещества | Примеры |
| Ковалентная | Любых | Образование электронных пар. Незначительная деформация | Молекулы, кристаллы | N2, H2O, FeCl3 |
| Ионная | Любых | Образование электронных пар, сильно притянутых к одному из атомов. Значительная деформация оболочек | Молекулы, кристаллы имеющие на некоторых атомах частичные заряды (+ и -) | NaF, KCl, CsF |
| Металлическая | Атомы металлов | Делокализация валентных электронов. | Металлическая решетка, в узлах которой находятся атомы металлов | Fe, Ni, Cu. |
424. В ряду HF - HCl - HBr - HI происходит увеличение длины связи вследствие увеличения радиуса атомов галогенов в ряду F - Cl - Br - I, поскольку происходит добавление новых электронных слоев.
425. В ряду H2O- H2S-H2Se-H2Te происходит увеличение длины связи вследствие увеличения радиуса атомов элементов в 6 группе от кислорода к теллуру вследствие добавления электронных слоев.
426. В ряду С2Н6-С2Н4-С2Н2 происходит уменьшение длины связи, т.к. между атомами углерода происходит увеличение кратности связи. Так, у этана кратность связи равна 1, у этилена -2, у ацетилена -3.
427. В ряду HF - HCl - HBr - HI происходит уменьшение энергии связи, поскольку увеличивается радиус атома галогенов от фтора к йоду. Чем больше радиус атома, тем меньше нужно затратить энергии, чтобы разрушить молекулу.
428. В ряду СF4 - СCl4 - СBr4 - СI4 происходит уменьшение энергии связи, поскольку увеличивается радиус атома галогенов от фтора к йоду. Чем больше радиус атома, тем меньше нужно затратить энергии, чтобы разрушить молекулу.
429. В ряду С2Н2 - С2Н4 - С2Н6 происходит уменьшение энергии связи, т.к. между атомами углерода происходит уменьшение кратности связи. Так, у этана кратность связи равна 1, у этилена -2, у ацетилена -3. Чем больше кратность связи, тем прочнее молекула, тем больше нужно затратить энергии для ее разрушения.
430. Валентным углом называется угол между линиями связи (линия связи - линия, проходящая через центры ядер атомов) 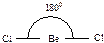 ,
, 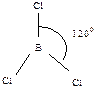 ,
, 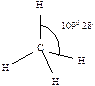 .
.
431. Теория валентных связей исходит из положения, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Т.е. химическая связь локализована между двумя атомами: она двуцентровая и двухэлектронная.
 Атом хлора имеет один неспаренный электрон, соответственно между двумя атомами хлора и между хлором и водородом может образоваться только одна связь за счет образования одной обобществленной электронной пары: Cl 3s2 3p5, H 1s1 => Сl-Cl, H-Cl. Валентные возможности атома азота ограничены тремя неспаренными электронами, поэтому с атомами кислорода в молекуле азотной кислоты азот связан как бы полуторными связями. Стехиометрическая валентность азота равна 5, степень окисления = +5, электронная валентность равна 4, кратность связей 1.5.
Атом хлора имеет один неспаренный электрон, соответственно между двумя атомами хлора и между хлором и водородом может образоваться только одна связь за счет образования одной обобществленной электронной пары: Cl 3s2 3p5, H 1s1 => Сl-Cl, H-Cl. Валентные возможности атома азота ограничены тремя неспаренными электронами, поэтому с атомами кислорода в молекуле азотной кислоты азот связан как бы полуторными связями. Стехиометрическая валентность азота равна 5, степень окисления = +5, электронная валентность равна 4, кратность связей 1.5.
432. Изменение валентности атома в большинстве случаев происходит за счет возбуждения, при котором распаривается электронная пара, образуя два неспаренных электрона. Т.е. валентность увеличивается на 2. Соответственно у р-элементов переменной валентности она различается на 2. Атом фтора имеет один неспаренный электрон на р-орбитали и не имеет вакантных орбиталей для возбуждения, т.е. его валентность всегда равна 1. Атом Cl имеет подобную оболочку, однако у него есть возможность переходить в возбужденное состояние за счет перехода электронов на вакантные d-орбитали. Соответственно, Cl может иметь валентность 1,3,5,7. F 2s22p5, Cl 3s2 3p53d0. ClF, ClF3, ClF5, ClF7.
433. Валентное состояние электронов, орбиталей и атома в целом означает возможность образования атомом химической связи. Атом фтора имеет один неспаренный электрон на р-орбитали и не имеет вакантных орбиталей для возбуждения, т.е. его валентность всегда равна 1. F 2s22p5. Атом хлора имеет подобную оболочку, однако у него есть возможность переходить в возбужденное состояние за счет перехода электронов на вакантные d-орбитали. Соответственно, хлор может иметь валентность 1,3,5,7. Cl 3s2 3p53d0. Атом кислорода имеет два неспаренных электрона на р-орбитали и подобно фтору не имеет вакантных орбиталей для возбуждения, т.е. его валентность всегда равна 2. О 2s22p4. Сера, как и хлор, находится в третьем периоде, в котором есть вакантная d-орбиталь. Соответственно сера может быть 2-,4-,6-тивалентной. S 3s2 3p43d0. Для атома бериллия, валентные электроны которого находятся на 2s орбитали вакантной является 2р-орбиталь, на которую может происходить возбуждение электронов. Валентность всегда бериллия равна 2. Ве 2s22p0. Бор имеет на один электрон больше, чем бериллий, т.е. его валентность всегда равна 3 (поскольку 2s- и 2р-орбитали близки по энергии, возбуждение бериллия протекает очень легко и валентность 1 для него не характерна). В 2s22p1. Углерод имеет на один электрон больше, чем бор; его валентность равна 4 (поскольку 2s- и 2р-орбитали близки по энергии, возбуждение углерода, как и бериллия, протекает очень легко и валентность 2 для С не характерна). С 2s22p2.
434. Находясь в основном состоянии элементы обычно имеют немного неспаренных электронов, однако многие элементы способны переходить в возбужденное состояние, что приводит к появлению дополнительных неспаренных электронов, что увеличивает валентные возможности элементов. Основное состояние атома характеризуется минимумом энергии, в то время как возбужденное состояние характеризуется избыточной энергией. Когда атом находится в возбужденном состоянии его электроны могут распариваться и переходить на вакантные орбитали. PCl3, PCl5. Валентная конфигурация атома фосфора в основном состоянии: 3s23p3, т.е. валентность фосфора в основном состоянии равна 3. Следовательно в молекуле PCl3 фосфор находится в основном, а в PCl5 - возбужденном состоянии. H2S, SO3. Валентная конфигурация атома серы в основном состоянии: 3s23p4, т.е. валентность серы в основном состоянии равна 2. Следовательно в молекуле H2S сера находится в основном, а в SO3 - возбужденном состоянии.
435. Главной причиной образования химической связи между атомами является стремление к минимуму энергии: при образовании связи электронные облака перестраиваются так, что новая система энергетически более выигрышна, чем предыдущая, представляющая собой два отдельных атома (молекулы). О перекрывании электронных облаков при образовании молекулы водорода говорит тот факт, что линейный размер молекулы меньше суммы диаметров двух атомов водорода.
436. Образование одиночной связи (σ-связь) происходит вдоль линии связывания, при этом происходит наибольшее перекрывание, поэтому σ-связь наиболее прочная. Вторая и третья связь (π-связь) образуются над линией связи, при этом сильного перекрывания электронных облаков не происходит, поэтому энергия σ-связь + π-связь не равна удвоенной σ-связи.
| Одинарная связь | 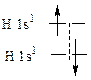
|
| Двойная связь | 
|
| Тройная связь | 
|
437. а) только σ-связь: СН4, NaCl, KF
б) одна σ-связь + одна π-связь: О2, СО2
в) одна σ-связь + две π-связи: N2, CO
438. SF6 - шесть σ-связей (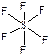 ), SO3 - три σ-связи + три π-связи (
), SO3 - три σ-связи + три π-связи (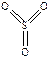 ), POCl3, - четыре σ-связи + одна π-связь (
), POCl3, - четыре σ-связи + одна π-связь (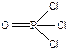 ), C2H2, - три σ-связи + две π-связи (
), C2H2, - три σ-связи + две π-связи (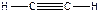 ), C2H4, - пять σ-связей + одна π-связь (
), C2H4, - пять σ-связей + одна π-связь ( ), COCl2, - три σ-связи + одна π-связь (
), COCl2, - три σ-связи + одна π-связь ( ), SO2Cl2. - четыре σ-связи + две π-связи (
), SO2Cl2. - четыре σ-связи + две π-связи ( ).
).
439. Образование ковалентной связи по донорно-акцепторному механизму происходит следующим образом: один атом является донором электронной пары, а второй – имеет вакантную орбиталь и является акцептором. Например: Нٱ +:NH3 = [NH4]+. У водорода имеется вакантная орбиталь, а у азота – электронная пара. При образовании донорно-акцепторной связи стехиометрическая валентность азота увеличилась на 1, а степень окисления и электронная валентность не изменились. Стехиометрическая валентность и степень окисления водорода увеличились на 1, а электронная валентность не изменилась.
440. С2Н6 - между атомами углерода образована одинарная связь, в то время как в молекуле С2Н4 между атомами углерода образована двойная связь, в результате чего в С2Н4 энергия связи между С-С выше. В бензоле - С6Н6 - между атомами углерода формально двойная связь, однако она делокализована по всему углеродному кольцу, из-за чего энергия связи С-С ниже, чем в этилене.

| Молекула диамагнитна.
KK(σ2sсв)2(σ2sр)2(σ2рхсв)2(πсв2ру,2pz)4(πp2ру,2pz)4
Кратность связи = 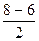 =1, т.е. F-F
При отрыве электрона энергия связи увеличится, т.к. внешний электрон находится на разрыхляющей МО. =1, т.е. F-F
При отрыве электрона энергия связи увеличится, т.к. внешний электрон находится на разрыхляющей МО.
|

| Молекула парамагнитна.
KK(σ2sсв)2(σ2sр)2(σ2рхсв)2(πсв2ру,2pz)4(πp2ру,2pz)2
Кратность связи = 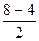 =2, т.е. О=О
При отрыве электрона энергия связи увеличится, т.к. внешний электрон находится на разрыхляющей МО. =2, т.е. О=О
При отрыве электрона энергия связи увеличится, т.к. внешний электрон находится на разрыхляющей МО.
|

| Молекула диамагнитна.
KK(σ2sсв)2(σ2sр)2(σ2рхсв)2(πсв2ру,2pz)4
Кратность связи =  =3, т.е. С≡О
При отрыве электрона энергия связи уменьшится, т.к. внешний электрон находится на связывающей МО. =3, т.е. С≡О
При отрыве электрона энергия связи уменьшится, т.к. внешний электрон находится на связывающей МО.
|
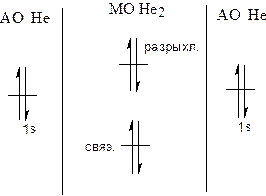
| Согласно теории Мо, молекула может существовать, если кратность связей (р) больше 0. А) р(Не2) = (2-2)/2 = 0 – молекула не существует Б) Отрыв одного электрона осуществляется с разрыхляющей МО: р = (2-1)/2 = 0.5 – молекула существует. В) He2- - не существует, т.к. 5 электронов не могут разместиться на двух МО. Г) НеF не может существовать, т.к. энергия АО Не и F сильно отличаются. Д) НеН. Р = (2-10/2 = 0.5 Молекула может существовать. |
445. Ионизационный потенциал характеризует энергию, необходимую для отрыва электрона от атома. Согласно теории МО электроны легче оторвать от разрыхляющих молекулярных орбиталей. Внешние электроны молекул водорода, углерода и азота находятся на связывающих МО, поэтому их легче оторвать от атомов, чем от молекул.
446. Ионизационный потенциал характеризует энергию, необходимую для отрыва электрона от атома. Согласно теории МО электроны легче оторвать от разрыхляющих молекулярных орбиталей. Внешние электроны молекул кислорода и азота находятся на разрыхляющих МО, поэтому их легче оторвать от молекул, чем от атомов.
| 
|
447. Ионизационный потенциал характеризует энергию, необходимую для отрыва электрона от атома. Согласно теории МО электроны легче оторвать от разрыхляющих молекулярных орбиталей молекулы, чем со связывающих орбиталей. Энергия, затрачиваемая на отрыв электронов от атомов имеет промежуточное значение между энергией электронов связывающих и разрыхляющих МО. Внешние электроны молекулы СО находятся на связывающих МО, поэтому их легче оторвать от молекулы, чем от отдельных атомов С и О.

|
448. Согласно теории МО, чем больше кратность связи (р) молекулы, тем молекула устойчивее (больше Есв и меньше длина связи)

| Добавление электрона к О2 происходит на разрыхляющую МО: устойчивость уменьшается. Удаление электрона с разрыхляющей МО, наоборот, делает молекулу устойчивее:
р(О2) = 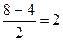 р(О2+) = р(О2+) = 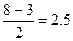 р(О2-) =
р(О2-) = 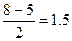 р(О22-) = р(О22-) = 
|
449. а) – невозбужденная, т.к. на p2р-связывающих орбиталях азота находятся спаренные электроны, на разрыхляющих p2р-орбиталях азота неспаренных электронов нет.
б)-возбужденная
451. Появление теории гибридизации было вызвано необходимостью объяснить геометрию многоатомных молекул. Основные положения: число гибридных орбиталей всегда равно числу атомных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий: 1) хорошее перекрывание гибридизуемых электронных орбиталей; 2) небольшая разница в энергиях атомных орбиталей, участвующих в гибридизации. Гибридизация всегда сопровождается изменением формы электронного облака.
| Тип гибридизации орбиталей центрального атома | Геометрическая модель гибридных орбиталей | Пример |
| sp sp2 sp3 sp3d sp3d2 sp3d3 | Прямая линия Плоский треугольник Тетраэдр Тригональная бипирамида Октаэдр Пентагональная бипирамида | СО2 BF3 H2O PCl5 SF6 ClF7 |
452. Пространственное положение гибридных орбиталей определяется строением валентной оболочки центрального атома (количество неспаренных электронов, участвующих в связи и количество несвязывающих электронных пар)
| Тип гибридизации орбиталей центрального атома | Геометрическая модель гибридных орбиталей | Пример |
| sp sp2 sp3 sp3d2 | Прямая линия (угол 1800) Плоский треугольник(угол 1200) Тетраэдр(угол 1090) Октаэдр(угол 900) | СО2 BF3 H2O SF6 |
453. Гибридное облако всегда асимметрично: имеет б о льшую вытянутость по одну сторону ядра, чем по другую. Поэтому химические связи, образованные с участием гибридных орбиталей, обладают большей прочностью, чем связи за счет чистых негибридных облаков. О гибридизации судят по строению валентной оболочки центрального атома (количество неспаренных электронов, участвующих в связи и количество несвязывающих электронных пар) и по валентным углам в молекуле.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1612; Нарушение авторских прав?; Мы поможем в написании вашей работы!