
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Межмолекулярное взаимодействие. Агрегатное состояние вещества
|
|
|
|
459.
458.
454.
| Анион | Структурная формула | Тип гибридизации | Геометрия аниона |
| СО32- | 
| sp2 | Треугольник |
| SО42- | 
| sp3 | Тетраэдр |
| NО3- | 
| sp2 | Треугольник |
455. В молекуле СОCl2 у центрального атома углерода в образовании связей участвуют все четыре электрона, но три из них образуют σ-связи, а один π-связь. Согласно теории гибридизации, электроны, образующие π-связь не принимают участие в гибридизации, поэтому гибридных АО не четыре а три.
456. а) Чем больше несвязывающих электронных пар, тем меньше валентный угол (CH4 -нет несвязывающих пар, NH3 - 1 пара, H2O - 2 несвязывающих пары). б) Чем больше электроотрицательность партнера центрального атома, тем сильнее влияние несвязывающей электронной пары и тем меньше валентный угол (ЭО(Cl)>ЭО(Br)>ЭО(I). в) Чем дальше от ядра валентные орбитали, тем сильнее влияние несвязывающей электронной пары и тем меньше валентный угол ra(N)< ra(P)< ra(As)< ra(Sb).
457. Форма молекул и ионов зависит от типа гибридизации центрального атома и от строения его валентного слоя. Если валентная оболочка центрального атома не содержит неподеленных электронных пар, то частица будет иметь правильную геометрическую форму (СН4 - тетраэдр, SF6 - октаэдр). Если неподеленные электронные пары присутствуют, то у частицы будет незавершенная геометрическая форма (NH3 - незавершенный тетраэдр), либо искаженная форма (Н2О - искаженная линейная структура).
| Поделен.эл.пары | Неподел.эл.пары | Тип гибридизации | Расположение эл. пар | Геометрич. форма молекулы | примеры |
| sp3 | Тетраэдрическое | Тетраэдр | CH4, NH4+ | ||
| sp3 | Тетраэдрическое | Тригон. Пирамида | NH3, PF3 | ||
| sp3 | Тетраэдрическое | Угловая | H2S, H2O | ||
| sp3d | Тригональное бипирамидальное | Тригон. бипирамида | PCl5 | ||
| sp3d | Тригональное бипирамидальное | Неправ. Тетраэдр | TeCl4 | ||
| sp3d | Тригональное бипирамидальное | Т-образная | ClF3 | ||
| sp3d2 | октаэдрическое | Октаэдр | SF5 | ||
| sp3d2 | октаэдрическое | Квадратн. Пирамида | IF5 | ||
| sp3d2 | октаэдрическое | Плоский квадрат | ICl4-, XeF4 |
| СО2 и SO2: В молекуле СО2 у центрального атома sp-гибридизация, а в молекуле SO2 за счет одной неподеленной электронной пары у атома серы sp2-гибридизация. Поэтому СО2 – линейная молекула, а SO2 – имеет угловую форму. |
| BCl3 и NCl3 В молекуле BCl3 у центрального атома sp2-гибридизация, а в молекуле NCl3 за счет одной неподеленной электронной пары у атома азота sp3-гибридизация. Поэтому BCl3 – плоская треугольная молекула, а NCl3 – имеет форму пирамиды. |
| CF4 и XeF4 В молекуле СF4 у центрального атома sp3-гибридизация, а в молекуле XeF4 за счет неподеленных пар у атома ксенона sp3d2-гибридизация. Поэтому СF4 – тетраэдрическая молекула, а XeF4 – имеет форму октаэдра. |
460. а) В молекуле BF3 центральный атом имеет sp2-гибридизацию, в то время как в ионе BF4- у атома бора sp3-гибридизация. Поэтому при переходе от молекулы к иону форма меняется от плоского треугольника к тетраэдру. б) В молекуле NH3 у атома азота sp3-гибридизация, однако одна гибридизованная орбиталь содержит неподеленную электронную пару, из-за чего углы в тетраэдре искажены. В катионе NH4+ - гибридизованные орбитали не содержат неподеленных электронных пар, т.е. тетраэдр не искажен. в) Подобно этому, в молекуле воды Н2О у атома кислорода sp3-гибридизация, однако на двух гибридных орбиталях имеются электронные пары, из-за чего углы тетраэдра искажены очень сильно. Менее искажены углы в Н3О+, т.к. в этом катионе только одна гибридная орбиталь содержит неподеленные электронные пары.
461. Явление, называемое поляризацией химической связи, представляет собой деформацию электронной оболочки под действием сильного электромагнитного поля соседнего атома. Полярность связи тем выше, чем больше разница в электроотрицательности атомов, образующих связь: ЭО(Н) = 2,1.
| ЭО(элемента) | Разница ׀ЭО(Н)-ЭО(элемента)׀ | Смещение электронного облака | Место по увеличению полярности |
| (N) = 3.0 | 0.9 | К азоту | |
| (S) = 2.5 | 0.4 | К сере | |
| (Li) = 1.0 | 1.1 | К водороду | |
| (O) = 3.5 | 1.4 | К кислороду | |
| (I) = 0.133 | 1.967 | К водороду |
462. Ковалентная полярная связь характеризуется направленностью, насыщаемостью и поляризуемостью. Насыщаемость ковалентной связи - вследствие насыщаемости связи молекулы имеют определенный состав и существуют в виде дискрентных частиц с определенной структурой (Н2О, NH3, FeCl2). Направленность ковалентной связи - поскольку электронные облака имеют различную форму, их взаимное перекрывание может осуществляться разными способами. В зависимости от способа перекрывания и симметрии образующегося облака различают σ-, π-, δ-связи. Сигма-связь осуществляется при перекрывании облаков вдоль линии соединения атомов. Пи-связь возникает при перекрывании электронных облаков по обе стороны от линии соединения атомов. Дельта-связь образуется при перекрывании всех четырех лопастей d-электронных облаков, расположенных в параллельных плоскостях. Например, в молекуле азота одна сигма и две пи-связи N≡N. Поляризуемость ковалентной связи - свойство характеризует способность становится полярной в результате действия на молекулу внешнего электрического поля. Например, в молекуле HCl связь под действием внешнего поля поляризуется и может даже разорваться.
463. Электрический момент диполя μ представляет собой произведение длины диполя l на значение электрического заряда q: μ = l*q. Т.е. его величина зависит от расстояния между концами диполя и зарядом на полюсах диполя. Электрический момент диполя измеряется в Кл . м. Экспериментально определяется спектроскопическими методами. Если известны дипольные моменты связей в молекуле, то общий дипольный момент молекулы рассчитывается как векторная сумма моментов связей. Так, например, дипольный момент симметричной молекулы СО2 равен нулю, несмотря на то, что связи С=О имеют сильно полярный характер, а угловая молекула воды Н2О имеет дипольный момент отличный от нуля.
464. При поляризации связи молекула приобретает электрический дипольный момент, т.е. получается диполь, на полюсах которого образуются заряды, которые называются эффективными. Этот заряд δ можно установить экспериментально. Согласно имеющимся данным эффективный заряд на атоме водорода молекулы НCl составляет δН = +0.18, а на атоме хлора = -0.18 абсолютного заряда электрона. Можно сказать, что связь в молекуле HCl имеет на 18% ионный характер, т.е. полярна. Эффективный заряд совпадет со степенью окисления по знаку, но не совпадает по значению.
465. Электроотрицательность характеризует способность атома в соединении оттягивать на себя электронную плотность. ЭО определяется экспериментально как относительная безразмерная величина. Если разница в ЭО двух атомов больше или равна 2.1, то связь между ними можно считать ионной:
| Соединение | Разность электроотрицательностей элементов | Связь |
| NaCl | 3-0.9 = 2.1 | Ионная |
| MgCl2 | 3-1.2 = 1.8 | Близка к ионной |
| AlCl3 | 3-1.5 = 1.5 | Близка к ионной |
| SiCl4 | 3-1.8 = 1.2 | Полярная |
| PCl3 | 3-2.1 = 0.9 | Полярная |
| SCl4 | 3-2.5 = 0.5 | Слабо полярная |
| Cl2 | 3-3 = 0 | Неполярная |
466. Образование ионной связи характеризуется очень сильным смещением электронной плотности к одному из атомов. 100%-я ионная связь не может быть образована, т.к. не может быть полного перехода электронов от одного атома к другому. В наиболее ионных соединениях доля ковалентности не превышает 10%. Наиболее ионным соединением является FrF, т.к. разница в электроотрицательностях этих элементов максимальна.
467. Поляризующим действием иона называется способность иона деформировать электронную оболочку атома, с которым образована химическая связь. Поляризуемостью иона называется способность его электронной оболочки деформироваться под действием электромагнитного поля атома, с которым образована химическая связь. Чем больше заряд иона и меньше его радиус, тем больше его поляризующее действие и меньше поляризуемость. Соответственно, чем меньше заряд иона и больше его радиус, тем меньше его поляризующее действие и больше поляризуемость. Радиус Ве меньше радиуса Ва, поэтому Ве2+ имеет большую поляризующую способность. Радиус алюминия больше радиуса железа, поэтому Fe2+ имеет большую поляризуемость. Радиус атома калия больше радиуса атома серебра и, кроме того, катион серебра имеет 18-электронный внешний слой (что также усиливает поляризующее действие), поэтому Ag+ поляризует связь больше. Радиус аниона фтора меньше, чем анион иода, соответственно, поляризуемость иода выше. Ион Те2- крупнее иона S2-, следовательно ион теллура поляризуется сильнее.
468. Из катионов наибольшим поляризующим действием, как известно, обладает водород. Поляризующим действием иона называется способность иона деформировать электронную оболочку атома, с которым образована химическая связь, т.е. делать связь менее устойчивой. Из-за того, что водород сильнее деформирует связь, чем катион любого металла, кислоты разрушаются легче (при меньшей температуре), чем соответствующие соли.
469. Поскольку радиус катиона кадмия меньше радиуса катиона кальция, катион кадмия имеет более сильное поляризующее действие. Поляризующим действием иона называется способность иона деформировать электронную оболочку атома, с которым образована химическая связь, т.е. делать связь менее устойчивой. Из-за того, что кадмий сильнее деформирует связь, чем кальций, соли кадмия разрушаются легче (при меньшей температуре), чем соответствующие соли кальция.
470. Fe, Cu, Pb - это вещества с металлической связью. Металлическая связь отличается от ковалентной тем, что в случае металлической связи часть электронов способна свободно перемещаться по всему объему куска металла. Кроме того при образовании металлической связи атомы не связаны друг с другом локализованными двухэлектронными связями. Способность металлов проводить электричество и тепло есть следствие именно наличия электронов, легко перемещающихся в металле. Пластичность металлов объясняется способностью металлической решетки деформироваться при механическом воздействии без разрыва связей. При повышении температуры возбуждаются электроны с глубинных слоев атомов металлов, в результате вакантных орбиталей для свободного перемещения электронов становится меньше - уменьшается электропроводность.
471. Водородная межмолекулярная связь образуется в том случае, когда молекула содержит водород, связанный с сильно электроотрицательным атомом (O, F, N, Cl). При этом электронная плотность оттягивается от водорода на соседний атом и образуется внутримолекулярный диполь. Две и более молекулы способны притягиваться друг к другу за счет взаимодействия разноименных полюсов этих диполей. Образование водородных связей возможно между HF.
472. Водородная межмолекулярная связь образуется в том случае, когда молекула содержит водород, связанный с сильно электроотрицательным атомом (O, F, N, Cl). При этом электронная плотность оттягивается от водорода на соседний атом и образуется внутримолекулярный диполь. Чем более электроотрицательный атом связан с водородом, тем сильнее водородная связь, поэтому наибольшая энергия водородных связей между HF, а наименьшая между NH3.
473. Аномально высокая температура кипения плавиковой кислоты объясняется наличием между ее молекулами водородных связей. Водородная межмолекулярная связь образуется в том случае, когда молекула содержит водород, связанный с сильно электроотрицательным атомом (O, F, N, Cl). При этом электронная плотность оттягивается от водорода на соседний атом и образуется внутримолекулярный диполь. Две и более молекулы способны притягиваться друг к другу за счет взаимодействия разноименных полюсов этих диполей.
474. Аномально высокая растворимость в воде плавиковой кислоты по сравнению с соляной кислотой объясняется наличием между молекулами HF водородных связей. Молекулы воды также притянуты друг к другу водородными связями. Между HF и H2O возможно сильное межмолекулярное взаимодействие, а между водой и HCl межмолекулярное взаимодействие гораздо слабее. В результате растворимость фтороводорода выше.
475. Аномально высокая растворимость в воде аммиака по сравнению с фосфином объясняется наличием между молекулами NH3 водородных связей. Молекулы воды также притянуты друг к другу водородными связями. Между NH3 и H2O возможно сильное межмолекулярное взаимодействие, а между водой и PH3 межмолекулярное взаимодействие гораздо слабее. В результате растворимость аммиака выше.
476. Аномально высокая растворимость в воде серной кислоты по сравнению с соляной кислотой объясняется наличием между молекулами H2SO4 водородных связей. Молекулы воды также притянуты друг к другу водородными связями. Между H2SO4 и H2O возможно сильное межмолекулярное взаимодействие, а между водой и HCl межмолекулярное взаимодействие гораздо слабее. В результате растворимость серной кислоты выше соляной.
477. Природа водородных связей электростатическая, а при образовании ковалентной связи взаимодействие настолько сильное, что электронные оболочки атомов перекрываются, поэтому длина ковалентной связи во много раз меньше водородной. Димер H2F2 представляет собой две молекулы плавиковой кислоты притянутые друг к другу водородной связью. Н - F---F - H. Водородная связь HF гораздо длиннее ковалентных связей HF.
478. С увеличением молекулярной массы температура кипения однотипных веществ увеличивается. Однако, в предложенном ряду температура кипения воды имеет аномально высокое значение из-за наличия между молекулами Н2О водородных связей. Дополнительное связывание между молекулами приводит к увеличению температуры кипения воды, поэтому ее температура кипения не укладывается в типичную закономерность.
479. Водородные связи между молекулами воды имеют крайне важное значение, поскольку, благодаря этому дополнительному взаимодействию, вода при н.у. жидкая, обладает упорядоченностью ближнего порядка и некоторыми другими полезными свойствами. Если бы водородные связи отсутствовали, вода при н.у. была газообразной, и жизнь в том виде, в котором она существует сейчас, вряд ли была.
480. Внутримолекулярная связь имеет место в соединении 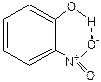 . Внутримолекулярная связь изменяет валентные углы, немного увеличивает температуру его кипения.
. Внутримолекулярная связь изменяет валентные углы, немного увеличивает температуру его кипения.
481. 1) Водородная связь не является разновидностью ковалентной, т.к. при ее образовании не происходит образования электронных пар, перекрывания электронных облаков и энергия водородной связи намного меньше энергии ковалентной связи. 2) Донорно-акцепторный механизм - это один из видов образования ковалентной связи, а водородная связь не является ковалентной. 3) Метод МО описывает образование молекул, а при образовании водородной связи новых молекул не образуется.
482. Вандерваальсовским взаимодействием называются такие взаимодействия, как дисперсионное, индукционное и ориентационное. Вандерваальсовское взаимодействие осуществляется за счет электростатических сил, в то время как химические связи образуются при взаимодействии электронов. Дисперсионное взаимодействие наблюдается, например, между молекулами хлора, атомами благородных газов. При увеличении размера атома увеличивается дисперсионное взаимодействие - увеличивается температура кипения вещества. Индукционное взаимодействие осуществляется, например, между полярными молекулами воды и неполярными молекулами спирта, что соответствует процессу растворения спирта в воде. Ориентационное взаимодействие осуществляется, например, между полярными молекулами аммиака. Данный вид взаимодействия ответственен за увеличение температуры кипения веществ.
483. Вандерваальсовским взаимодействием называется взаимодействие молекул, которое осуществляется за счет электростатических сил. Переход в конденсированное состояние Ne, N2, Cl2 обусловлен дисперсионным взаимодействием. Переход в конденсированное состояние HI, BF3, H2O обусловлен ориентационным взаимодействием.
484. Универсальным взаимодействием, действующим между всеми молекулами, является дисперсионное взаимодействие: образование между молекулами мгновенных микродиполей.
485. Вандерваальсовское взаимодействие делится на три вида. 1) Дисперсионное взаимодействие: образование между молекулами мгновенных микродиполей. Синхронное появление и исчезновение микродиполей разных молекул приводит к их взаимному притяжению. 2) Ориентационное взаимодействие проявляется между полярными молекулами. В результате беспорядочного теплового движения молекул при сближении их друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие. 3) Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей. При сближении полярной и неполярной молекул неполярная молекула деформируется, и в ней наводится индуцированный дипольный момент, в результате молекулы притягиваются. Не способны к индукционному и ориентационному взаимодействию неполярные молекулы N2, Ar, He, Cl2.
486. Дисперсионное взаимодействие: H2 + O2, H2 + H2O, H2O + NH3, NH3 + NF3, NF3 + BF3, HCl + HCl, HF + HF. Индукционное взаимодействие: H2 + H2O, H2O + NH3, NH3 + NF3, NF3 + BF3, HCl + HCl, HF + HF. Ориентационное взаимодействие: H2O + NH3, NH3 + NF3, NF3 + BF3, HCl + HCl, HF + HF.
487. При повышении порядкового номера благородного газа возрастает размер атома - увеличивается дисперсионное взаимодействие между атомами - в результате увеличивается температура кипения.
488. Увеличение температуры кипения в ряду BF3, BCl3, BBr3, BI3, объясняется ростом вклада дисперсионного взаимодействия между молекулами при увеличении их размеров. Дисперсионное взаимодействие: образование между молекулами мгновенных микродиполей. Синхронное появление и исчезновение микродиполей разных молекул приводит к их взаимному притяжению. Ориентационное взаимодействие проявляется между полярными молекулами. В результате беспорядочного теплового движения молекул при сближении их друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие. Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей. При сближении полярной и неполярной молекул неполярная молекула деформируется, и в ней наводится индуцированный дипольный момент, в результате молекулы притягиваются. Обсуждение таблицы: не способны к индукционному и ориентационному взаимодействию неполярные молекулы, поэтому между Ar и СО действует только дисперсионное взаимодействие. Молекула HCl мало полярная, поэтому вклад дисперсионного взаимодействия больше, чем ориентационного и индукционного, в то время как для полярных молекул воды и аммиака наблюдается обратная закономерность.
489. В методичке нет условия
490. Ион-дипольным взаимодействием называется индукционные силы Вандерваальса. Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей. При сближении полярной и неполярной молекул неполярная молекула деформируется, и в ней наводится индуцированный дипольный момент, в результате молекулы притягиваются. К+ + H2O, H2O + NH4+, NH3 + NF3, NF3 + BF3, H+ + HCl, HF + HF. Оно проявляется, например, при растворении спирта в воде.
491. Данный вид межмолекулярного взаимодействия описывает ориентационные силы Вандерваальса. Взаимодействие происходит при диссоциации сильного электролита (NaCl) в воде.
492. При образовании гидратов и клатратов между частицами и молекулами воды действуют силы Вандерваальса. При образовании связи между водой и полярной молекулой (NH3*H2O, H2SO4*H2O, H2SO4*2H2O, CuSO4*5H2O) действуют ориентационные силы, а между водой и неполярной молекулой (Ar*8H2O) - индукционное взаимодействие.
493. Уравнение Вандерваальса: 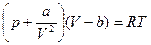 , где а/V2 - поправка на давление, b - поправка на объем реального газа.
, где а/V2 - поправка на давление, b - поправка на объем реального газа.
494. Агрегатные состояния: твердое (в свободном состоянии не твердое тело изменяет форму и объем) → жидкое (в свободном состоянии жидкое тело принимает форму сосуда, в котором находится, но не изменяет объем) → газообразное (в свободном состоянии принимает форму сосуда, в котором находится, может изменять объем).
495. Кристаллическое состояние характеризуется наличием дальнего порядка в решетке, в то время как аморфное состояние вещества определяется как отсутствие дальнего порядка в объеме. Аморфные вещества обладают значительной вязкостью, а кристаллические практически не вязкие. Кристаллические вещества классифицируются на ионные (ионная связь: решетка NaCl), ковалентные (ковалентная связь: решетка PbO), молекулярные (молекулярная связь, решетка СО2), металлические (металлическая связь: решетка Fe).
496. Поваренная соль: NaCl (ионная связь - ионная решетка), алмаз и графит: С (ковалентная связь, ковалентная кристаллическая решетка), кремнезем: SiO2 (ковалентная связь, ковалентная кристаллическая решетка), железо: Fe (металлическая связь - металлическая решетка), сухой лед: СО2 (молекулярная связь - молекулярная кристаллическая решетка).
497. Необходимо все три порошка разместить в разные сосуды с дистиллированной водой. Сразу идентифицировать не растворившийся песок. Затем в оставшиеся сосуды опустить разомкнутые концы электрической цепи, в которую включена лампочка. Т.к. раствор хлорида натрий проводит электрический ток, то в сосуде, содержащем NaCl цепь замкнется и лампочка загорится. Раствор с сахаром - это оставшийся третий сосуд.
498. Дальтониды - NaCl, CaF2, MgO. Бертоллиды - TiO0.8-1.7, CuxOy, MnS0.9-1.1. Бертоллиды имеют переменный состав, т.к. их кристаллические решетки имеют очень высокую дефектность - выпадение атомов из узлов решетки, либо, наоборот, внедрение атомов в решетку. В зависимости от степени и вида дефектности меняется состав бертоллида.
499. Полиморфизм - способность вещества при определенных температурах и давлениях образовывать в твердом состоянии различные типы кристаллических структур. Например, SiC имеет более сорока модификаций, у олова их две - белое и серое. Изоморфизм - сходство пространственной структуры и химической природы веществ. Например, медь и серебро имеют одинаковую структуру решетки - гцк. Полиморфные модификации: диоксид кремния - 3 (кварц, кристобаллит, тридимит), фторид кальция - 2, железо - 4 (α, β, δ, γ).
500. Идеальным называется кристалл, не имеющий дефектов. Реальные кристаллы содержат поверхностные (дислокации, гряды, ступеньки и т.д.) и объемные дефекты (внедрения, замещения, вычитания). Наличие дефектов сильно изменяет свойства кристаллов: меняется ковкость, пластичность, электро- и теплопроводность. Химическая активность дефектных структур обычно увеличивается.
Блажен лишь тот, кто по утру
Имеет стул без принужденья
Тому и пища по нутру
И прочие мирские наслажденья.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1441; Нарушение авторских прав?; Мы поможем в написании вашей работы!