
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория гибридизации и ОЭПВО 1 страница
|
|
|
|
450.
С
443.
С
441.
372.
              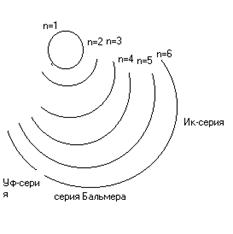
| Серим Лаймана соответствуют переходы с более удаленных орбиталей на орбиту с n=1. Серии Бальмера - переходы на n=2. Серии Пашена - переходы на орбиты с n=3,4,5. |
373. Для расчета энергии возбуждения электрона с одного уровня на другой используется уравнение:  . Энергия перехода с 1 на 2 уровень равна 44 ккал/г-атом, Энергия перехода с 1 на 5 уровень равна 70 ккал/г-атом.
. Энергия перехода с 1 на 2 уровень равна 44 ккал/г-атом, Энергия перехода с 1 на 5 уровень равна 70 ккал/г-атом.
374. а) Принцип квантования и дискретности энергии: электрон не изменяет энергию непрерывно, переходя с одной орбиты на другую, изменение энергии электрона происходит скачкообразно. Т.е. энергетические состояния электрона в атоме дискретны.
б) Корпускулярно-волновая двойственность: электрон имеет свойства как частицы, так и волны.
в) Принцип неопределенности: нельзя одновременно и точно определить скорость электрона и его координаты.
Таким образом, электрон в атоме вращается по определенным орбитам с дискретной энергией. Поглощение или выделение энергии происходит только при переходе электрона с одной орбиты на другую.
375. Квантовая механика изучает движения и взаимодействия микрочастиц. Она основывается на представлении о квантовании энергии, волновом характере движения микрочастиц и вероятностном методе описания микрообъектов. Основным уравнением квантовой механики является волновое уравнение Шредингера, которое связывает волновую функцию с потенциальной полной энергией электрона. Волновые функции, получаемые решением этого уравнения, описывают орбитали.
376. Совокупность положений электрона в атоме, характеризуемых определенными значениями квантовых чисел называют атомной орбиталью.

377. а) Главное квантовое число (n) соответствует номеру энергетического слоя, в котором находится электрон.
б) Орбитальное квантовое число (l) определяет форму орбитали, форму электронного облака.
в) Магнитное квантовое число (m) определяет пространственную ориентацию орбиталей.
г) Спиновое квантовое число (s) определяет направление собственного вращения электрона.
378. Энергию электрона определяют главное, спиновое и магнитное квантовые числа. Наиболее существенно зависит энергия электрона от главного квантового числа, наименее - от магнитного. Магнитное квантовое число влияет на энергию электронов в пределах одного подуровня.
379. Энергетический уровень - набор атомных орбиталей с одинаковым значением главного квантового числа (n). Энергетический подуровень - набор атомных орбиталей с одинаковым значением орбитального квантового числа (l) внутри данного энергетического уровня. Число энергетических подуровней для данного энергетического уровня равно 2n2. Если энергетический уровень расщеплен на 4 подуровня, то n=2.
380. Электронный слой - это совокупность электронов с одинаковым значением главного квантового числа n. В электронном слое с n = 1 наибольшее количество содержащихся электронов - 2, в n = 2 - 8 электронов, в n = 3 - 18 электронов, в n = 4 - 32 электрона, в n = 5 - 50, в n = 6 - 72, в n = 7 - 98. Максимально теоретически допустимое количество электронов в слое равно 2n2.
381. Форму орбитали в пространстве определяет побочное квантовое число L. L принимает значения от 0 до (n - 1). Значению L=0 отвечает сферическая форма орбитали:  . Значению L=1 отвечает гантелеобразная форма орбитали:
. Значению L=1 отвечает гантелеобразная форма орбитали: 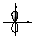 . Расположение орбиталей в пространстве определяет магнитное квантовое число ML. Например: гантелеобразные р-облака могут располагаться в пространстве тремя видами:
. Расположение орбиталей в пространстве определяет магнитное квантовое число ML. Например: гантелеобразные р-облака могут располагаться в пространстве тремя видами: 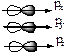
 . Размер орбиталей определяется главным квантовым числом n. Чем больше n, тем дальше внешние электроны находятся от ядра и тем больше электронное облако.
. Размер орбиталей определяется главным квантовым числом n. Чем больше n, тем дальше внешние электроны находятся от ядра и тем больше электронное облако.
382. Число атомных орбиталей (AO) определяется магнитным квантовым числом ML., оно равно (2L + 1). Так, на s-подуровне количество AO равно 1, т.к. для s-подуровня L=0. на р-подуровне число AO равно 3, т.к. L=1. На d-подуровне число AO равно 5, т.к. L = 2.
383. S-электронное облако имеет форму шара. Оно обладает сферической симметрией. Р-облако имеет гантелеобразную форму и обладает осевой симметрией. D-облака имеют форму скрещенных гантелей и осевую симметрию.
384. Фосфор, № 15. 1s22s22p63s23p3. Атом фосфора имеет в нормальном состоянии 3 неспаренных электрона на 3р-подуровне. При возбуждении электроны с 3s-подуровня распариваются, и один из них переходит на вакантную орбиталь d-подуровня, образуя при этом 5 неспаренных электронов.

| валентные электроны | n | L | ML | S |
| 3s | +1/2 | ||||
| 3s | -1/2 | ||||
| 3p | +1 | +1/2 | |||
| 3p | +1/2 | ||||
| 3p | -1 | +1/2 |
385. Сера, № 16. 1s22s22p63s23p4. Атом серы имеет в нормальном состоянии 2 неспаренных электрона на 3р-подуровне. При возбуждении электроны с 3s- и 3р-подуровней могут распариваться, и переходить на вакантные орбитали d-подуровня, образуя при этом 4 или 6 неспаренных электронов.

| Элек-троны | 3s | 3p | |||||
| Кв. числа | ||||||||
| N | ||||||||
| L | ||||||||
| M | -1 | -1 | +1 | |||||
| S | 1/2 | -1/2 | 1/2 | -1/2 | 1/2 | 1/2 |
386. Алюминий, № 13. 1s22s22p63s23p1. Атом алюминия имеет в нормальном состоянии 1 неспаренный электрон на 3р-подуровне. При возбуждении электрон с 3s-подуровня может распариться, и перейти на вакантную орбиталь 3d-подуровня, образуя при этом 3 неспаренных электрона.

| Элек-троны | 3s | 3p | |||||
| Кв. числа | ||||||||
| N | ||||||||
| L | ||||||||
| M | -1 | |||||||
| S | 1/2 | -1/2 | 1/2 |
387. Кремний, № 14. 1s22s22p63s23p2. Атом кремния имеет в нормальном состоянии 2 неспаренных электрона на 3р-подуровне. При возбуждении электроны с 3s-подуровня могут распариваться, и переходить на вакантные орбитали d-подуровня, образуя при этом 4 неспаренных электрона.
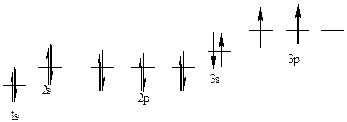
| Элек-троны | 3s | 3p | |||||
| Кв. числа | ||||||||
| N | ||||||||
| L | ||||||||
| M | -1 | |||||||
| S | 1/2 | -1/2 | 1/2 | 1/2 |
388. Хлор, № 17. 1s22s22p63s23p5. Атом хлора имеет в нормальном состоянии 1 неспаренный электрон на 3р-подуровне. При возбуждении электроны с 3s- и 3р-подуровней могут распариваться, и переходить на вакантные орбитали d-подуровня, образуя при этом 3, 5 или 7 неспаренных электронов.

| Элек-троны | 3s | 3p | |||||
| Кв. числа | ||||||||
| N | ||||||||
| L | ||||||||
| M | -1 | -1 | +1 | |||||
| S | 1/2 | -1/2 | 1/2 | -1/2 | 1/2 | -1/2 | 1/2 |
389. Хром, № 24. 1s22s22p63s23p64s23d4. Атом хрома имеет в нормальном состоянии 4 неспаренных электрона на 3d-подуровне. При возбуждении электроны с 4s-подуровня могут распариваться, и переходить на вакантные орбитали 3d-подуровня, образуя при этом 6 неспаренных электронов.

| Электроны | 4s | 3d | |||||||||
| Квантовые числа | ||||||||||||
| N | ||||||||||||
| L | ||||||||||||
| M | -2 | -1 | +1 | |||||||||
| S | 0.5 | -0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
390. Ванадий, № 23. 1s22s22p63s23p64s23d3. Атом ванадия имеет в нормальном состоянии 3 неспаренных электрона на 3d-подуровне. При возбуждении электроны с 4s-подуровня могут распариваться, и переходить на вакантные орбитали 3d-подуровня, образуя при этом 5 неспаренных электронов.

| Электроны | 4s | 3d | |||||||||
| Квантовые числа | ||||||||||||
| N | ||||||||||||
| L | ||||||||||||
| M | -2 | -1 | ||||||||||
| S | 0.5 | -0.5 | 0.5 | 0.5 | 0.5 |
391. Современная формулировка: Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра элементов. Формулировка Менделеева: свойства элементов находятся в периодической зависимости от их атомных весов. Изменение формулировки произошло в связи с работами Мозли (1912 г.), который показал, что истинной основой закона являются не атомные веса, а положительные заряды ядер атомов, численно выражаемые (в е -единицах) атомными номерами соответствующих элементов.
392. Менделеев предсказал существование трех элементов: галлий, скандий, германий. Свойства элементов, предсказанные Менделеевым совпали очень точно, например, для германия:
| Предсказано Менделеевым (1871) | Найдено Винклером (1886) |
| Атомный вес ~72 Удельный вес ~5,5 Металл не вытесняет водород из кислот Оксид ЭО2 Удельный вес оксида 4.7 и др. | 72.6 5.35 металл не растворяется в HCl, H2SO4 GeO2 4.70 и др. |
393. В 1869 году истинную природу периодического изменения свойств элементов предсказать было невозможно, т.к. еще не была раскрыта структура атома. В настоящее время периодичность изменения свойств элементов связывается с ростом положительных зарядов ядер атомов. Поскольку атом электронейтрален, с ростом положительного заряда ядра увеличивается количество электронов, окружающих атом. Электроны заполняют оболочку последовательно - при этом свойства элементов также периодически изменяются.
394. Атомный номер элемента совпадает с количеством протонов в ядре атома элемента. С ростом атомного номера увеличивается положительный заряд ядра. Соответственно, увеличивается количество электронов, окружающих ядро. Электроны заполняют оболочку вокруг ядра строго последовательно. В связи с этим свойства атомов изменяются периодически.
395. Периодическая система является по отношению к периодическому закону графической формой. ПС содержит в себе громадное количество информации как явной, так и скрытой. Каждый вариант ПС - это способ наглядно представить ту или иную группу периодических свойств элементов. Короткопериодный вариант удобен своей компактностью. В нем наглядно показано как и почему различные элементы объединены в главные и побочные подгруппы. Однако, в короткопериодном варианте периодической системы нелогично разнесены в разные части таблицы d-металлы, разделенные группой благородных газов. Длиннопериодный вариант ПС наглядно представляет периоды, т.к. d-металлы находятся в логичном для них месте. Однако, в длиннопериодном варианте не ясно отражена связь между главными и побочными подгруппами элементов.
396. Короткопериодный вариант удобен своей компактностью. В нем наглядно показано как и почему различные элементы объединены в главные и побочные подгруппы. Однако, в короткопериодном варианте периодической системы нелогично разнесены в разные части таблицы d-металлы, разделенные группой благородных газов.
Длиннопериодный вариант ПС наглядно представляет периоды, т.к. d-металлы находятся в логичном для них месте. Однако, в длиннопериодном варианте не ясно отражена связь между главными и побочными подгруппами элементов.
397. Являющаяся наглядным выражением периодического закона, система элементов Д.И. Менделеева складывается из периодов и групп. Периодов в системе семь, из них три малых и четыре больших. Каждый период (кроме первого и последнего) включает в себя элементы, электронные структуры которых являются промежуточными между структурами двух последовательных инертных газов. Из малых периодов первый содержит только водород и гелий, остальные два - по 8 элементов. Из больших периодов четвертый и пятый содержат по 18 элементов, шестой - 32 элемента и седьмой остается незаконченным. Группы периодической системы объединяют входящие в них элементы по признаку химического сродства. Из них восьмая включает в себя инертные газы, а триады содержат только элементы, относящиеся к большим периодам. В каждой из остальных групп имеются по две подгруппы элементов больших периодов.
398. Элементы одного периода объединяет то, что их внешние (валентные) электроны находятся в одном электронном слое. Элементы одной группы сходны в количестве валентных электронов. Элементы одной группы, но разных подгрупп различаются тем, что они относятся к разным семействам. У элементов одного семейства общим является то, что последний электрон у атомов этих элементов находится на орбиталях с одинаковым орбитальным квантовым числом (l).
399. Периодическая система элементов Д.И. Менделеева складывается из периодов и групп. Периодов в системе семь, из них три малых и четыре больших. Каждый период (кроме первого и последнего) включает в себя элементы, электронные структуры которых являются промежуточными между структурами двух последовательных инертных газов. Из малых периодов первый содержит только водород и гелий, остальные два - по 8 элементов. Из больших периодов четвертый и пятый содержат по 18 элементов, шестой - 32 элемента и седьмой остается незаконченным. Группы периодической системы объединяют входящие в них элементы по признаку химического сродства. Из них восьмая включает в себя инертные газы, а триады содержат только элементы, относящиеся к большим периодам. В каждой из остальных групп имеются по две подгруппы элементов больших периодов. Т.о. емкость уровня совпадает с его заполненостью только для первого и второго периодов. В случае третьего и последующих периодов емкость больше количества элементов. Это связано со следующим явлением: из-за разницы в энергии d- и f-орбитали выталкиваются в верхние электронные слои.
400. Периодическая система элементов Д.И. Менделеева складывается из периодов и групп. Периодов в системе семь, из них три малых и четыре больших. Каждый период (кроме первого и последнего) включает в себя элементы, электронные структуры которых являются промежуточными между структурами двух последовательных инертных газов. Из малых периодов первый содержит только водород и гелий, остальные два - по 8 элементов. Из больших периодов четвертый и пятый содержат по 18 элементов, шестой - 32 элемента и седьмой остается незаконченным. Число электронов в электронном слое определяется принципом Паули (в одном атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел).
Емкость уровня совпадает с его заполненостью только для первого и второго периодов. В случае третьего и последующих периодов емкость больше количества элементов. Это связано со следующим явлением: из-за разницы в энергии d- и f-орбитали выталкиваются в верхние электронные слои.
401. Число элементов в периоде определяется значением главного квантового числа: 2n2. Т.е. в седьмом периоде должно содержаться 98 элементов. Последний элемент должен иметь порядковый номер 86+14+10+6 = 116. Он будет являться аналогом радона.
402. Водород и гелий помещают соответственно в первую и вторую группы, т.к. они являются электронными аналогами соответствующих элементов. Однако, физико-химические свойства водорода и гелия более сходны с элементами, соответственно, седьмой и восьмой групп. Водород схож с галогенами по следующим признакам: газообразный, в свободном состоянии - димер. Гелий, как и благородные газы, чрезвычайно инертен.
403. До 1963г. благородные газы помещали в т.н. «нулевую группу», которая располагалась перед группой щелочных металлов. после определения точного строения электронной оболочки благородных газов, было выяснено, что она является не началом электронного слоя, а его завершением. Поэтому сейчас группу благородных газов помещают в последнюю восьмую группу.
404. Атомный номер элемента совпадает как с количеством протонов в ядре его атома, так и с числом электронов. Поскольку последовательность заполнения электронами электронных слоев известна, то, зная количество электронов, можно легко определить положение элемента в ПС.
Элемент №20: электронная формула - 1s22s22p63s23p64s2. Это s-элемент, активный металл. В соединениях имеет положительную степень окисления +2. Формула оксида МеО, гидроксида Ме(ОН)2. Оксид и гидроксид имеют основные свойства и т.д.
Элемент №34: электронная формула - 1s22s22p63s23p64s23d104p4. Это p-элемент, неметалл. В соединениях может иметь степени окисления -2, +2, +4, +6. Наиболее устойчивой является СО = +4. Формула оксида ЭО2, гидроксида Э(ОН)4. Оксид и гидроксид имеют амфотерные свойства и т.д.
405. Элемент №19: электронная формула 1s22s22p63s23p64s1. Четвертый период, первая группа, главная подгруппа. Это s-элемент, активный металл. В соединениях имеет положительную степень окисления +1. Формула оксида Ме2О, гидроксида МеОН. Оксид и гидроксид имеют основные свойства и т.д. Элемент №35: электронная формула 1s22s22p63s23p64s23d104p5. Четвертый период, 7 группа, главная подгруппа. Это p-элемент, неметалл. В соединениях может иметь степени окисления -1, +1, +3, +5, +7. Наиболее устойчивой является СО = -1. Формула гидрида НЭ, гидроксида НЭО1,3,5,7. Оксиды и гидроксиды имеют кислотные свойства и т.д.
406. Внутри периодов слева направо размеры атомов уменьшаются. Это происходит вследствие усиления взаимодействия положительно заряженного ядра с отрицательно заряженными электронами по мере заполнения ими одного и того же электронного слоя. По группам сверху вниз радиус атома увеличивается из-за добавления новых электронных слоев. Соответственно наименьший радиус имеет атом гелия, а наибольший - атом франция. При увеличении радиуса атома усиливается металличность элемента, уменьшается его электроотрицательность, сродство к электрону.
407. Орбитальный радиус - радиус атома измеряемый от центра ядра до положения главного максимума плотности внешних электронных облаков. Ковалентный радиус - радиус атома в молекуле, построенной по типу ковалентной связи. Металлический радиус - радиус атома в металлической решетке. Эффективный радиус - практический радиус атома, связанного с другими атомами. Внутри периодов слева направо размеры атомов уменьшаются. Это происходит вследствие усиления взаимодействия положительно заряженного ядра с отрицательно заряженными электронами по мере заполнения ими одного и того же электронного слоя. По группам сверху вниз радиус атома увеличивается из-за добавления новых электронных слоев. При увеличении радиуса атома усиливается металличность элемента, уменьшается его электроотрицательность, сродство к электрону.
408. Изменение ионизационного потенциала обратно пропорционально изменению атомного радиуса. Внутри периодов слева направо размеры атомов уменьшаются. Это происходит вследствие усиления взаимодействия положительно заряженного ядра с отрицательно заряженными электронами по мере заполнения ими одного и того же электронного слоя. По группам сверху вниз радиус атома увеличивается из-за добавления новых электронных слоев. Т.е. по периодам ионизационный потенциал увеличивается, а по группам - уменьшается. При уменьшении ионизационного потенциала усиливается металличность элемента, уменьшается его электроотрицательность, сродство к электрону.
409. Ионизационный потенциал и энергия ионизации - это количественные характеристики энергии отрыва электрона от атома. Ионизационный потенциал (ИП) измеряется в эВ, а энергия ионизации (ЭИ) в кДж/моль. ИП(Li) = 5.19 эВ, следовательно, ЭИ(Li) = 5.19*96486 = 500 кДж/моль. ЭИ(О) = 1313.0 кДж/моль, следовательно, ИП(О) = 1313.0/96.486 = 13.6 эВ. Радиус атома кислорода значительно меньше радиуса атома лития. Соответственно, взаимодействие внешних электронов с ядром в атоме кислорода выше, а значит выше и ИП кислорода. Можно сделать следующий вывод: чем выше ИП, тем сильнее выражены неметаллические свойства элемента.
410. На внешней орбите у атома бериллия находятся два электрона, близкие по энергии. Соответственно ионизационные потенциалы для этих электронов близки. В противоположность этому, первый и второй электроны атома лития расположены в различных электронных слоях. И, если первый электрон отрывается относительно легко, то второй электрон, находящийся гораздо ближе к ядру, оторвать значительно сложнее. Отсюда и разница в ионизационных потенциалах.
411. Атомы типичных металлов отличаются от атомов типичных неметаллов значительно большими радиусами, а значит у металлов меньше энергия ионизации, электроотрицательность и сродство к электрону. Металлы в большинстве - твердые (при н.у.) вещества, проводники, ковкие, пластичные и т.п. В соединениях металлы имеют только положительные степени окисления, в то время как неметаллы имеют как отрицательные, так и положительные СО. Амфотерные металлы, в отличие от типичных металлов, могут проявлять основные и кислотные свойства как в свободном состоянии, так и в соединениях. Металлические свойства зависят от радиуса атома. Чем больше радиус атома, тем сильнее выражены металлические свойства элемента. Внутри периодов слева направо размеры атомов уменьшаются. Это происходит вследствие усиления взаимодействия положительно заряженного ядра с отрицательно заряженными электронами по мере заполнения ими одного и того же электронного слоя. По группам сверху вниз радиус атома увеличивается из-за добавления новых электронных слоев. Т.е. с увеличением порядкового номера по периодам металличность уменьшается, а по группам увеличивается. Неметаллы - хлор, кислород, гелий, кремний, углерод. Металлы - франций, натрий, уран, магний. Амфотерные металлы - алюминий, германий, олово, цинк.
412. Металлические свойства зависят от радиуса атома. Чем больше радиус атома, тем сильнее выражены металлические свойства элемента. Внутри периодов слева направо размеры атомов уменьшаются. Это происходит вследствие усиления взаимодействия положительно заряженного ядра с отрицательно заряженными электронами по мере заполнения ими одного и того же электронного слоя. По группам сверху вниз радиус атома увеличивается из-за добавления новых электронных слоев. Т.е. по периодам металличность уменьшается, а по группам увеличивается.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 518; Нарушение авторских прав?; Мы поможем в написании вашей работы!