КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика. 3 страница
|
|
|
|
352. 4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(г), ΔH0= -116.4 кДж/моль. а) равновесие сместится в сторону исходных веществ при повышении температуры, уменьшении давления, увеличении концентрации хлора и воды, понижении концентрации кислорода и соляной кислоты. Б) равновесие сместится в сторону продуктов при понижении температуры, увеличении давления, уменьшении концентрации хлора и воды, увеличении концентрации кислорода и соляной кислоты.
353. 3Fe(к) + 4H2O(г) = Fe3O4(к) + 4H2(г), ΔH0= -49,9 кДж/моль. Для увеличения выхода водорода необходимо понизить температуру, т. к. реакция протекает с выделением тепла. Давление не влияет на положение равновесия, т.к. количество газообразных продуктов равно количеству газообразных исходных веществ.
354. MgO(k) + CO2 (г) = MgCO3(к), ΔH0= -111,7 кДж/моль. Поглощение CO2 будет происходить при понижении температуры и повышении давления. Восстановление поглотителя будет протекать при повышении температуры и понижении давления.
355. CaO + H2O = Ca(OH)2.
ΔH0 = -986.6+635.5+241.8 = -109.3 кДж/моль. ΔS0 = 76.1-39.7-188.7 = -152.3 Дж/(K*моль)
ΔG0 = ΔH0 - Т * ΔS0. ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT
а) Т = 300 К. ΔG0 = -109.3 + 300*152.3*10-3 = -63.61 кДж/моль. Кр = 1.2*1011
б) Т = 1000 К. ΔG0 = -109.3 + 1000*152.3*10-3 = 43 кДж/моль. Кр = 5.7*10-3
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие экзотермической реакции смещается влево.
356. N2O3 = NO + NO2.
ΔH0 = 90.2 + 33.5 - 83.3 = 40.4 кДж/моль. ΔS0 = 210.6 + 240.2 - 178.2 = 272.6 Дж/(K*моль)
ΔG0 = ΔH0 - Т * ΔS0. ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT
а) Т = 00 C = 273 К. ΔG0 = 40.4 - 273*272.6*10-3 = -34.0 кДж/моль. Кр = 3.3*106
б) Т = 373 К. ΔG0 = 40.4 - 373*272.6*10-3 = -61.3 кДж/моль. Кр = 3.9*108
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
357. 2H2O = 2H2 + О2.
ΔH0 = 2*241.8 = 483.6 кДж/моль. ΔS0 = 2*130.5 - 205 - 2*188.7 = -321.4 Дж/(K*моль)
ΔG0 = ΔH0 - Т * ΔS0. ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT
а) Т = 500 К. ΔG0 = 483.6 + 500*321.4*10-3 = 644.3 кДж/моль. Кр = 4.5*10-68
б) Т = 1000 К. ΔG0 = 483.6 + 1000*321.4*10-3 = 805 кДж/моль. Кр = 8.5*10-43
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
358. ZnO + H2 = Zn + H2O.
ΔH0 = -241.8 + 350.6 = 108.8 кДж/моль. ΔS0 = 41.6 + 188.7 - 43.6 - 130.5 = 56.2 Дж/K*моль
ΔG0 = ΔH0 - Т * ΔS0. ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT
а) Т = 300 К. ΔG0 = 108.8 - 300*56.2*10-3 = 91.94 кДж/моль. Кр = 9.6*10-17
б) Т = 1000 К. ΔG0 = 108.8 - 1000*56.2*10-3 = 52.6 кДж/моль. Кр = 5.7*10-3
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
359. FeO + H2 = Fe +H2О.
ΔH0 = -241.8 + 264.8 = 23 кДж/моль. ΔS0 = 27.3 + 188.7 - 60.8 -130.5 = 24.7 Дж/(K*моль)
ΔG0 = ΔH0 - Т * ΔS0. ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT
а) Т = 500 К. ΔG0 = 23 - 500*24.7*10-3 = 10.65 кДж/моль. Кр = 0.077
б) Т = 1000 К. ΔG0 = 23 - 1000*24.7*10-3 = -1.7 кДж/моль. Кр = 1.23
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
360. 2HI = H2 + I2.
ΔH0 = 2*26.6 = 53.2 кДж/моль. ΔS0 = 130.5 + 116.2 - 2*206.5 = -166.3 Дж/(K*моль)
ΔG0 = ΔH0 - Т * ΔS0.
Т = 400 К. ΔG0 = 53.2 + 400*166.3*10-3 = 119.7 кДж/моль.
ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT => Кр = 2.2*10-16
Согласно закону Оствальда Кр = 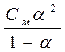 . Т.к. константа равновесия очень мала, то можно пренебречь знаменателем. Тогда
. Т.к. константа равновесия очень мала, то можно пренебречь знаменателем. Тогда 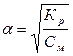 = 4.8*10-5 %. К данному расчету принцип Ле-Шателье применить нельзя, т.к. не рассматривается смещение равновесия.
= 4.8*10-5 %. К данному расчету принцип Ле-Шателье применить нельзя, т.к. не рассматривается смещение равновесия.
361. В состав атома входят протоны и нейтроны (они образуют ядро атома) и электроны. Протоны являются носителями положительного заряда, их количество определяет величину заряда ядра и атомный номер химического элемента, масса покоя протона: 1,673*10-27 кг, заряд: 1,602*10-19 Кл. Электроны - носители отрицательного заряда, масса покоя электрона: 9,109*10-31 кг, заряд: 1,602*10-19 Кл. Нейтроны - нейтральные частицы (заряд равен нулю), масса покоя: 1,675*10-27 кг.
362.
| Частица | символ | Масса покоя, кг | Относительная масса, а.е.м. | Заряд, Кл |
| протон | p | 1,673*10-27 | 1,007276 | 1,602*10-19 |
| нейтрон | n | 1,675*10-27 | 1,008665 | |
| электрон | e | 9,109*10-31 | 0,000549 | 1,602*10-19 |
363. Согласно модели Резерфорда, атом состоит из ядра, в котором сосредоточена основная масса атома, и электронов, движущихся на относительно большом расстоянии от ядра. Однако эта модель противоречила факту устойчивого существования атомов: в результате движения электроны расходуют энергию притяжения с ядром, и через 10-8 секунды они должны упасть на ядро. Кроме того, электроны теряют энергию за счет излучения, образующего сплошной спектр, что также противоречило фактам: все атомные спектры имеют линейчатый характер.
В 1913 г. Бор предложил теорию строения водородного атома. Основными отличиями от предыдущей теории были следующие: электроны двигаются по строго определенным орбитам, до тех пор пока электрон находится на этой орбите, он не излучает. При переходе электрона с одной орбиты на другую выделяется энергия, что объясняет происхождение атомных спектров. Однако, теория Бора не пригодна к описанию строения сложных атомов.
Современная теория строения атома включает в себя квантово-механические представления: наличие у электрона свойств волны и частицы, невозможность одновременного определения координаты и импульса микрочастицы, применение волновой функции ψ для описания свойств электрона.
365. Атомная масса химического элемента рассчитывается как сумма вкладов атомных масс изотопов. Атомная масса хлора равна А(Cl) = 35*75.53%/100% + 37*24.47%/100% = 35.49 а.е.м.
366. Атомная масса химического элемента рассчитывается как сумма вкладов атомных масс изотопов. Атомная масса меди равна А(Cu) = 63*73%/100% + 65*27%/100% = 63.54 а.е.м. Результат не совпадает с табличным значением из-за т.н. «дефекта массы»: несовпадение значения суммы масс нуклонов и массы ядра, которое они составляют вследствие потери энергии.
367. Атомная масса химического элемента рассчитывается как сумма вкладов атомных масс изотопов. Атомная масса урана равна А(U) = 234*0.0058%/100% + 235*0.715%/100% + 238*99.28%/100% = 237.98 а.е.м. Результат не совпадает с табличным значением из-за т.н. «дефекта массы»: несовпадение значения суммы масс нуклонов и массы ядра, которое они составляют вследствие потери энергии.
368. Процессы взаимодействия ядер одних элементов с ядрами других элементов или с элементарными частицами, при которых образуются ядра новых элементов, получили название ядерных реакций. Ядерные реакции отличаются от химических тем, что в химических реакциях не происходит изменения ядерного состава. На Солнце протекает много ядерных реакций по суммарной схеме: 4р = α + 2е+ + 565 млн. ккал. Искусственно впервые осуществил ядерную реакцию Резерфорд (1919): 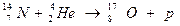 . В 1933 году Ирен и Фредерик Жолио-Кюри осуществили ядерную реакцию:
. В 1933 году Ирен и Фредерик Жолио-Кюри осуществили ядерную реакцию: 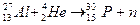
369. 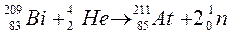
370. 
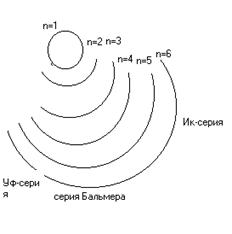
371. Спектры химических элементов получают путем сообщения атомам энергии, например в виде квантов света. При этом происходит возбуждение и переход электронов на более удаленные орбитали, возвращаясь с которых, они излучают. Таким образом получается линейчатый спектр испускания. Спектры имеют линейчатый вид, поскольку все переходы электронов дискретны, т.е. прерывисты. Спектр водорода состоит из трех серий: УФ - серии, серии Бальмера (видимый спектр) и ИК - серии. Перескокам с удаленных орбит на орбиту с n=1 соответствуют линии серии, лежащей в УФ-области, перескокам на орбиту с n=2 - линии серии Бальмера, перескокам на орбиты с n=3, 4, 5
|
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 432; Нарушение авторских прав?; Мы поможем в написании вашей работы!