
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эквиваленты и закон эквивалентов
|
|
|
|
100.
98.
76.
| Дано V(CH4) = 0.03 м3 Р(СН4) = 96.0 кПа V(H2) = 0.04 м3 Р(Н2) = 84.0 кПа V(CО) = 0.01 м3 Р(СО) = 108.8 кПа | Найдем количество каждого вещества из закона Клайперона-Менделеева: n = PV/RT n(CH4) = 96*30/(8.31*298) = 1.163 моль. Доля газа х1 = 1.163*100%/2.959 = 39,3% n(H2) = 84*40/(8.31*298) = 1.357 моль. Доля газа х1 = 1.357*100%/2.959 = 45,9% n(CО) = 108.8*10/(8.31*298) = 0.439 моль. Доля газа х1 = 0.439*100%/2.959 = 14,8% Vобщ = 30 + 40 + 10 = 80 литров, n(общ) = 1.163+1.357+0.439 = 2.959 моль, следовательно, Робщ = nRT/V = 2.959*8.31*298/80 = 91.6 кПа Парциальные давления: П(СН4) = 91.6*0.393 = 36 кПа, П(Н2) = 91.6*0.459 = 42 кПа, П(СО) = 91,6*0.148 = 13,6 кПа |
77. V1(N2) = 120мл = 0.120 л; Т = 200С = 293 К; Р(общ) = 100 кПа, Р(Н2О) = 2.3 кПа. Vн.у.(N2) =?. Найдем парциальное давление азота: Р1(N2)= Р(общ) - Р(Н2О) = 100 - 2.3 = 97.3 кПа. 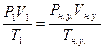 =>
=>  литра.
литра.
78. V1(Н2) = 250мл = 0.250 л; Т = 260С = 299 К; Р(общ) = 98.7 кПа, Р(Н2О) = 3.4 кПа. Vн.у.(Н2) =?. Найдем парциальное давление водорода: Р1(Н2)= Р(общ) - Р(Н2О) = 98.7 - 3.4 = 95.3 кПа. 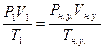 =>
=>  литра.
литра.
79. Закон Авогадро: В равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул.
Следствие 1. Объемы, занимаемые 1 моль газа, должны быть одинаковыми для всех газов.
Следствие 2. Один моль любого газа содержит 6,02*1023 соответствующих молекул.
Число Na = 6.02*1023 носит название постоянной Авогадро и выведено с использованием его закона. Из закона Авогадро следует, что два газа одинаковых объемов, хотя и содержат равное число молекул, имеют неодинаковые массы: масса одного газ во столько же раз больше массы другого газа, во сколько раз относительная молекулярная масса первого больше, чем относительная молекулярная масса второго. Закон Авогадро имел фундаментальное значение в истории развития атомно-молекулярного учения.
80. Закон Авогадро: В равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул. m(O2) = 8.0 г. n(O2) = m/M = 8 / 32 = 0.25 моль. V(O2) = n*Vм = 0.25 * 22.4 = 5.6 литров.
81. V(H2) = 280 литров. n(H2) = V/Vм = 280 / 22.4 = 12.5 моль. m(Н2) = n(H2)* M(Н2) = 12.5*2 = 25 грамм.
82. V(газа) = 600 мл. n(газа) = V/Vм = 0.6 / 22.4 = 0.0268 моль. M(газа) = m(газа) / n(газа) = 1.714 / 0.0268 = 64 грамм/моль.
83. n(СО2) = 10 моль. V(СO2) = n*Vм = 10 * 22.4 = 224 литра. m(СО2) = n(СО2)* M(СО2) = 10*44 = 440 грамм.
84. V(газа) = 2 л. n(газа) = V/Vм = 2 / 22.4 = 0.089 моль. а) Молярная масса газа: M(газа) = m(газа) / n(газа) = 2.5 / 0.089 = 28 грамм/моль. б) Молекулярная масса газа = 28. в) абсолютная масса одной молекулы m = 28 / 6,02*1023 = 4,65 *10-23 грамм.
85. а) Даны равные количества азота и водорода: n(H2) = n(N2). Согласно закону Авогадро, «в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул», т.е. отношение объемов азота и водорода равно 1.
б) Даны равные массы азота и водорода: m(H2) = m(N2). => V(H2) = n(H2)/Vм = =  =>
=> 
86. Газ называется идеальным, если газ подчиняется законам Клайперона-Менделеева и Рауля. Характеристика реального газа близка к идеальному, если форма его молекул близка к идеальному шару, если отсутствует взаимодействие между молекулами и столкновения молекул можно принять за упругое соударение. Молекулы водорода по свойствам более близки к идеальному газу, чем молекулы азота. Поэтому молярный объем водорода ближе к идеальному значению, чем молярный объем азота.
87. Относительная плотность газа вещества А по веществу B - отношение относительной молекулярной массы А к относительной молекулярной массе вещества B. DB(A)=M(A)/MB). Dвоздуху(Cl2) = M(Cl2)/M(воздуха) = 71/29 = 2.45; Dкислороду(С2Н4) = M(C2Н4)/M(О2) = 28/32 = 0.875.
88. Dвоздуху(Ацетона)=2. DB(A)=M(A)/MB), следовательно, М(ацетона) = Dвоздуху*М(воздуха) = 2*29 = 58 г/моль.
89. Dкислороду(Sx)=8. DB(A)=M(A)/MB), следовательно, М(Sx)= Dкислороду*М(кислорода) = 8*32 = 256 г/моль. х = М(Sx)/ М(S) = 256/32 = 8 атомов.
90. Dводороду(N2+O2)=15. DB(A)=M(A)/MB). Средняя молекулярная масса смеси азота и кислорода равна М(N2+O2) = Dводороду*М(водорода) = 15*2 = 30 г/моль. Пусть х и у - соответственно объемные доли азота и кислорода в смеси. Составим систему:
х*М(N2) + у*М(O2) = 30
х + у = 1, следовательно у = 1 - х
х*М(N2) + (1 - х)*М(O2) = 30 => 28x + 32 - 32x = 30 => x = 0.5 => y = 1 - 0.5 = 0.5
91. Валентностью данного элемента называется число атомов соединяющегося с ним другого элемента. К элементам переменной валентности относятся: азот: B=1 - N2O, B=2 - NO, B=3 - N2O3; железо: В=2 - FeO, B=3 Fe2O3, и многие другие элементы.
92. Валентностью данного элемента называется число атомов соединяющегося с ним другого элемента, т.е. валентность - это число связей с другими элементами, которые образует данный элемент. Постоянная валентность = 1: К, Li, Na, Rb - KCl, LiF, NaOH, RbF. Постоянная валентность = 2: Ca, Mg, Be - CaS, Mg(OH)2, BeCl2, Постоянная валентность = 3: Al, Ga, In - AlPO4, Ga(OH)3, InCl3, К элементам переменной валентности относятся: азот: B=1 - N2O, B=2 - NO, B=3 - N2O3; железо: В=2 - FeO, B=3 Fe2O3, и многие другие элементы.
93. Валентностью данного элемента называется число атомов соединяющегося с ним другого элемента, т.е. валентность - это число связей с другими элементами, которые образует данный элемент. Соответственно, максимальная валентность - это максимальное число связей, которые может образовать элемент в соединении. Максимальная валентность: P = 5 - H3PO4, Cl = 7 - HClO4, S = 6 - SO3, Xe = 8 - XeF8.
94. Максимальная валентность: Sn =4 - H2SnO3, Sb =5 - SbCl5, Se =6 - SeO3, Br =7 - HBrO4.
95. Максимальная валентность: V =5 - HVO3, Cr =6 - K2CrO4, Mn =7 - KMnO4, Ru =8 - RuO4.
96. Значения валентности различаются на 2 у: серы - SO2 / SO3, хлора - HClO / HClO2, таллия - TlCl / TlCl3.
97. Значения валентности различаются на 1 у: меди - Cu2O / CuO, железа - FeO / Fe2O3, титана - Ti2O3 / TiO2.
| Соединение | H2S | SO3 | H2SO3 | SO2 | H2SO4 | CS2 |
| Валентность серы |
99.
| Соединение | NH3 | N2O | NO | N2O3 | HNO2 | NO2 | N2O5 | HNO3 | NH4NO3 | NH4NO2 | N2H4 | Na3N |
| Валентность азота | 3,5 | 3,3 |
| Соединение | NaCl | CaCl2 | Cl2O | HClO | HClO2 | KClO3 | Cl2O7 | HClO4 |
| Валентность хлора |
101. По периоду максимальная валентность химических элементов увеличивается в связи с добавлением валентных электронов. Si: В=4 - SiO2, P: В=5 - PCl5, S: В=6 - SO3, I: В=7 - HIO4.
102. Максимальная валентность химического элемента совпадает с номером группы в ПС. Ge: В=4 - GeO2, P: В=5 - PCl5, Se: В=6 - SeO3, Cl: В=7 - HClO4.
103. Максимальная валентность химического элемента совпадает с номером группы в периодической системе, поэтому по периоду с увеличением атомного номера максимальная валентность увеличивается. По группе, в связи с уменьшением притяжения ядром валентных (внешних) электронов максимальная валентность с увеличением атомного номера уменьшается. Максимальная валентность Sn =4 - H2SnO3, Sb =5 - SbCl5, Тe =6 - ТeO3, Br =7 - HBrO4, Xe =8 - XeF8.
104. Максимальная валентность химического элемента совпадает с номером группы в ПС. Третий период - Na: B=1 - NaCl, Mg: B=2 - MgS, Al: B=3 - AlN, Si: В=4 - SiO2, P: В=5 - PCl5, S: В=6 - SO3, Cl: В=7 - HClO4.
105. Максимальная валентность химического элемента совпадает с номером группы в ПС. Четвертый период - K: B=1 - KCl, Ca: B=2 - CaS, Ga: B=3 - GaN, Ge: В=4 - GeO2, As: В=5 - AsCl5, Se: В=6 - SeO3, Br: В=7 - HBrO4.
106. Это переходные d-,f-металлы. Например, Co, Rh, Tb, Cm: Co(OH)3, RhCl3, TbCl3, CmBr3.
107. AlH3, Al2O3, AlN, Al4C3, Al2S3, AlF3
108. PH3, P2O5, AlN, Na3P, P2S5, PF5
109. Хлориды: BCl3,SiCl4, PCl5, SnCl2, MgCl2, Сульфиды: B2S3, SiS2, P2S5, SnS, MgS.
110. Оксиды азота: I - N2O, II - NO, III - N2O3, IV - NO2, V - N2O5; Марганца: II - MnO, III - Mn2O3, IV - MnO2, VI - MnO3, VII - Mn2O7; Хрома: II - CrO, III - Cr2O73, IV - CrO2.
111. Структурная формула не отражает реального строения молекулы или элементарной кристаллической решетки, однако позволяет рассчитать кратность связей в молекуле и валентность атомов. Al2O3 - O=Al-O-Al=O,
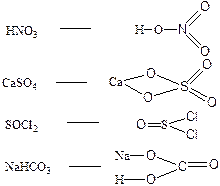
112. Структурная формула позволяет рассчитать кратность связей в молекуле и валентность атомов.
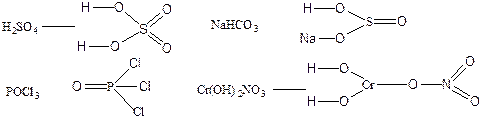
113. Структурная формула позволяет рассчитать кратность связей в молекуле и валентность атомов.

115. Валентность элементов совпадает с количеством связей между атомами в молекуле:
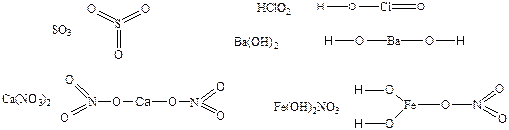
Структурная формула не отражает реального строения молекулы или элементарной кристаллической решетки.
116. Фосфорная кислота - трехосновная, фосфористая - двухосновная, фосфорноватистая - одноосновная (по числу атомов водорода, связанных с атомами кислорода).
117. Номер группы, в которой элемент расположен, совпадает с валентностью элемента по кислороду. Номер группы минус 8 - валентность элемента по водороду. Углерод (4 группа) - по кислороду В=4, по водороду В=8-4=4, азот (5 группа) - по кислороду В=5, по водороду В=8-5=3. сера (6 группа) - по кислороду В=6, по водороду В=8-6=2, хлор (7 группа) - по кислороду В=7, по водороду В=8-7=1.
118. В соединениях с кислородом валентность элемента совпадает с количеством валентных электронов, т.к. кислород притягивает электроны, а в соединении с водородом - с числом вакантных мест для электронов на валентном уровне, т.к. водород отдает электроны. Сумма вакантных мест и валентных электронов равна восьми, что объясняет наблюдаемую закономерность.
119. Электронная валентность кислорода одинакова, а стехиометрическая разная в соединениях: Н2О (Вэ=2, Вс=2) и Н2О2 - (Вэ=2, Вс=1).
120. Хлорид аммония: NH4Cl - электронная валентность =3, стехиометрическая = 4; перекись водорода: Н2О2 - электронная валентность =2, стехиометрическая = 1.
121. Эквивалент - реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Эквивалентная масса - масса одного эквивалента вещества. Молярная масса эквивалента - масса одного моль эквивалентов. Эквивалентная масса (Mэ), валентность (В), атомная масса (А) элемента связаны соотношением: 
Например, валентность азота в аммиаке равна 3, следовательно, молярная масса эквивалента азота: Мэ(N) = 14/3 = 4,66 г/моль
122.  . Э(Li) в LiH=1, Мэ(Li)=39/1=39 г/моль; Э(Be) в BeH2 = 2 Мэ(Be)=9/2=4.5 г/моль; Э(В) в ВН3=3 Мэ(В)=11/3=3.66 г/моль; Э(С) в СН4=4 Мэ(С)=12/4=3 г/моль.
. Э(Li) в LiH=1, Мэ(Li)=39/1=39 г/моль; Э(Be) в BeH2 = 2 Мэ(Be)=9/2=4.5 г/моль; Э(В) в ВН3=3 Мэ(В)=11/3=3.66 г/моль; Э(С) в СН4=4 Мэ(С)=12/4=3 г/моль.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1220; Нарушение авторских прав?; Мы поможем в написании вашей работы!