
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Переваривание и всасывание белков
|
|
|
|
Переваривание белков в желудочно-кишечном тракте - это часть метаболизма белков, совокупность управляемых процессов, осуществляемых в системе пищеварения, которые представляют собой химическую переработку белков поступающих в организм с пищей, для последующего их всасывания в кровь и в лимфу. Переваривание белков пищи предназначено для их денатурации, лишения видовой и тканевой специфичности и расщепления на простые компоненты способные всасываться в тонкой кишке в кровь. Еще в 50-х годах 20 века было установлено, что протеолизу подвергается только денатурированный белок. О степени перевариваемости белка судят по его перевариваемости протеазами. Нативный белок не подвергается протеолизу. В противном случае функционирование активных белков и само их существование было бы невозможным, поскольку протеолитические ферменты как участники белкового обмена присутствуют в каждой клетке. В живых организмах протеазы играют роль санитаров, расщепляя неактивные, денатурированные молекулы.
Почти все белки пищи (~95÷97%) всасываются в виде свободных аминокислот.
Расщепление белков пищи представляет собой гидролиз с участием катализаторов - протеолитических ферментов (протеазы, протеиназы, пептидазы). Каждый фермент из протеиназ разрывает вполне определенные пептидные связи белков. Специфичность действия зависит от размера полипептида, его структуры, разновидности аминокислот участвующих в образовании пептидных связей.
В зависимости от особенностей действия, пептидазы разделяют на две группы экзопептидазы и эндопептидазы. Экзопептидазы катализируют разрыв концевой пептидной связи. При этом высвобождается вполне определенная концевая аминокислота.
Эндопептидазы гидролизуют главным образом пептидные связи внутри полипептидной цепи. Разные эндопептидазы обладают специфичностью действия на субстрат гидролиза, зависящей от вида аминокислот в разрываемой пептидной связи. В связи с этим под действием разных эндопептидаз молекула белка расщепляется на определенное количество пептидов.
Переваривание белков пищи начинается в желудке (см. рис.8). Желудок является резервуаром, где потребленная пища находится в течение ~6÷8ч. Ёмкость желудка взрослого человека в среднем равна ~3л (1,5÷4,0л). В желудок поступает пища, которая подверглась существенной физической и незначительной химической переработке в полости рта. Химическая переработка пищи более интенсивно продолжается в желудке. Здесь происходит её постепенное перемешивание с желудочным соком и образование химуса. Желудочный сок содержит соляную кислоту и ферменты, катализирующие гидролиз пищевых веществ, главным образом белков. Слои химуса, прилегающие к стенке желудка, подготовленные в результате начального гидролиза для дальнейшего еще более интенсивного переваривания, периодически порциями перемещаются желудком в двенадцатиперстную кишку.
Соляная кислота желудочного сока играет существенную роль в переваривании белков. Она способствует набуханию белков, их денатурации, создает оптимальную кислотность среды для наилучшего действия ферментов, активирует проферменты, стимулирует секрецию гормонов принимающих участие в управлении функциями желудочно-кишечного тракта.
Желудочный сок содержит три главных протеазы: пепсин, реннин и гастриксин. Пепсин катализирует гидролиз пептидных связей почти всех натуральных белков (за исключением некоторых кератинов, протаминов, гистонов и мукопротеинов). В результате гидролиза белков образуются различного размера полипептиды, олигопептиды и небольшое количество свободных аминокислот.
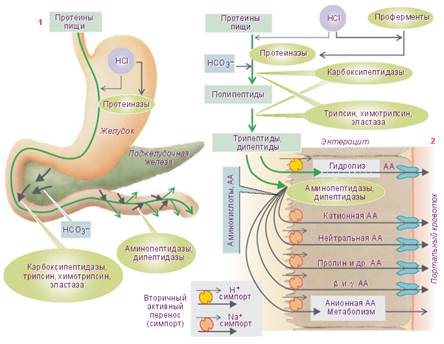
Рисунок 8. Переваривание белков пищи и всасывание аминокислот и олигопептидов в желудочно-кишечном тракте
В желудочном соке детей грудного возраста содержится фермент реннин. Он катализирует свертывание молока (превращение растворимого казеиногена в нерастворимый казеин). При таком свертывании молока замедляется продвижение нерастворимого казеина по желудочно-кишечному тракту. Благодаря этому увеличивается время действия протеиназ и обеспечивается эффективность усвоения белков. У взрослых свертывание молока осуществляется в большей степени пепсином.
Значительно более интенсивное, чем в желудке переваривание белков осуществляется в тонкой кишке. Начальным отделом её является двенадцатиперстная кишка. Двенадцатиперстная кишка имеет приблизительно в десять раз меньшую ёмкость, чем желудок. В то же время через двенадцатиперстную кишку проходит вся та масса химуса, которая находится в желудке. В полость двенадцатиперстной кишки выделяют свои секреты поджелудочная железа, бруннеровы железы и печень. Количество секретов на единицу поверхности двенадцатиперстной кишки, количество ферментов значительно больше, чем на единицу поверхности желудка. Все это объясняет тот факт, что интенсивность переваривания пищевых продуктов, в том числе и белков в двенадцатиперстной кишке приблизительно в четыре раза больше, чем в желудке.
Сок поджелудочной железы содержит пять главных ферментов: трипсин, химотрипсин, коллагеназу, карбоксипептидазу, эластазу. Трипсин и химотрипсин действуют на белки аналогично пепсину. Они наиболее активны в слабощелочной среде (рН = 7,2÷7,8) и разрушают внутренние пептидные связи. Таким образом, внутренние пептидные связи сложных белков последовательно разрывают три протеазы: пепсин желудочного сока, трипсин и химотрипсин сока поджелудочной железы. В результате образуются полипептиды различной длины и небольшое количество свободных аминокислот.
Дальнейший гидролиз полипептидов до свободных аминокислот осуществляется под влиянием группы более специфичных ферментов - пептидаз. Это карбоксипептидазы (карбоксиполи‑, карбокситри‑, карбоксидипептидазы) и аминопептидазы (аминополи‑, аминотри‑, аминодипептидазы). Эти ферменты разрушают концевые пептидные связи с образованием олигопептидов или свободных аминокислот (в соответствии с названием).
Кроме перечисленных ферментов сок поджелудочной железы содержит ферменты эластазу и коллагеназу. Они катализируют гидролиз эластина и коллагена. Как правило, конечные стадии гидролиза пищевых продуктов осуществляются в гликокаликсе и на мембране энтероцита (мембранное переваривание).
Образовавшиеся при этом простые вещества, в частности свободные аминокислоты, здесь же всасываются через мембрану энтероцита в его цитозоль, затем - в интерстициальное пространство микроворсинок, и далее - в кровь их микрогемациркуляторного русла. Большая часть аминокислот, всосавшихся в микрогемациркуляторное русло кишечных ворсинок, попадает с потоком крови через воротную вену в печень. Небольшое их количество поступает по лимфатическим сосудам в венозную систему. Аминокислоты всасываются посредством механизмов активного трансмембранного транспорта.
Нейтральные (не имеющие электрического заряда) аминокислоты и анионные («кислые», сопряженные кислоты) L–аминокислоты транспортируются по механизму вторичного (сопряженного) активного однонаправленного транспорта (симпорт) вместе с ионами натрия Na+. Так из полости тонкой кишки (в меньшей степени) и с поверхности гликокаликса (в большей степени) аминокислоты попадают в цитозоль энтероцитов. Отсюда они посредством пассивной диффузии или с помощью переносчиков транспортируются в кровь микрогемациркуляторного русла микроворсинок.
Катионные («основные», сопряженные основания) L –аминокислоты, такие как L –аргинин+, L –лизин+, L –орнитин+ могут частично перемещаться в цитоплазму энтероцита посредством механизмов, независимых от транспорта натрия. В этом случае движущей силой для их перемещения является электрический потенциал мембраны энтероцита.
Анионные аминокислоты, такие как L –глютамат– и L –аспартат имеют собственные механизмы транспорта, сопряженные с транспортом натрия Na+ и калия K+. По большей части эти аминокислоты в цитоплазме эритроцита разрушаются. Дипептиды и трипептиды могут транспортироваться в цитоплазму энтероцита посредством механизмов вторичного активного трансмембранного транспорта. Скорость такого транспорта значительно меньше, чем скорость транспорта свободных аминокислот. В цитоплазме энтероцитов дипептиды и трипептиды гидролизуются с образованием свободных аминокислот.
Всасывание продуктов гидролиза полинуклеотидов происходит путем пассивного или облегченного транспорта. Наряду с азотистыми основаниями через мембраны хорошо проникают и нуклеозиды. Поэтому в виде нуклеозидов всасывается часть продуктов переваривания нуклеиновых кислот.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 3942; Нарушение авторских прав?; Мы поможем в написании вашей работы!