
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Углеводы
|
|
|
|
Углеводы - один из основных классов органических соединений, встречающихся в природе. Название “углеводы” было первоначально дано потому, что многие соединения этого класса, (например, глюкоза С6Н12О6, сахароза С12Н22О11)) имеют эмпирическую формулу Сх (H2O) у и формально могут быть отнесены к «гидратам углерода». Позднее были выделены многие важные соединения (например, дезоксирибоза С5Н10О4), которые не могут быть описаны такой формулой, тем не менее термин «углевод» является общепринятым. К числу наиболее известных углеводов относятся глюкоза, сахароза, крахмал, клетчатка. Все эти соединения имеют большое значение для жизненных процессов как у животных, так и растений. Химия углеводов охватывает широкий круг вопросов от процессов фотосинтеза, который представляет собой процесс “связывания” углекислого газа и воды под влиянием энергии солнечных лучей с образованием углевода до процесса окисления глюкозы в организме с выделением энергии, которая запасается в организме в виде аденозинтрифосфата (АТФ) и затем расходуется в процессах жизнедеятельности организма:
солнечная энергия
 |
Классификация углеводов. Углеводы классифицируются на простые и сложные. Простые углеводы - моносахариды, простейшие углеводы, молекулы которых не подвергаются гидролизу. Сложные полисахариды - продукты конденсации моносахаридов. Полисахариды - это продукты поликонденсации большого числа моносахаридов. Полисахариды, состоящие из одного мономерного звена, называются гомополисахаридами. Моносахариды. Классификация. Моносахариды представляют собой гетерофункциональные соединения. Это многоатомные спирты, содержащие карбонильную группу, другими словами, полигидроксильные карбонильные соединения, содержащие неразветвленную углеродную цепь. Моносахариды классифицируют по числу атомов углерода в молекуле сахара на триозы, тетрозы, пентозы, гексозы, гептозы. Наиболее распространены пентозы и гексозы. В зависимости от природы карбонильной группы моносахариды делятся на альдозы, содержащие альдегидную группу, либо на кетозы, содержащие кетонную группу. Если объединить эти два признака, то все моносахариды можно разделить на альдопентозы, кетопентозы, кетогексозы, альдогексозы и т.д. Для всех моносахаридов характерно окончание” оза,” например глюкоза - альдогексоза, рибоза - альдопентоза, фруктоза - кетогексоза и т. д. Таким образом, моносахариды классифицируют сразу по двум признакам: по природе карбонильной группы и по числу углеродных атомов в молекуле. По номенклатуре ИЮПАК любую альдогексозу можно назвать как 2,3,4,5,6 - пентагидроксигексаналь, однако в химии углеводов используются исключительно тривиальные названия.
Стереоизомерия. В молекулах моносахаридов имеется несколько хиральных атомов, что служит причиной существования большого числа стереоизомеров, соответствующих одной и той же структурной формуле. Например в альдогексозе - четыре хиральных центра, и, следовательно, этой формуле соответствует 16 стереоизомеров
(2 4), т.е. 8 пар энантиомеров. Одним из этих стереоизомеров является глюкоза. Глюкоза по распространенности далеко превосходит все остальные моносахариды. Структура и свойства глюкозы будут рассматриваться более подробно, чем свойства других моносахаридов, не только вследствие ее большего значения, но и потому, что многое из относящегося к глюкозе справедливо также и для других моносахаридов. Глюкоза представляет собой альдогексозу, это означает, что в молекуле глюкозы шесть атомов углерода и имеется альдегидная группа. Для всех моносахаридов установлены относительные конфигурации, т. е. пространственное расположение заместителей у хиральных атомов относительно конфигурации (пространственного строения) D - глицеринового альдегида. Представить себе пространственное строение моносахаридов удобнее всего, если выводить их из D - глицеринового альдегида. Он существует в виде двух стереоизомеров, энантиомеров:
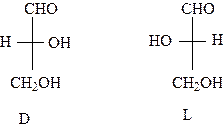 |
Глицериновый альдегид.
Принадлежность моносахарида к тому или иному ряду определяется по конфигурации его наиболее удаленного от альдегидной группы хирального центра. Если она совпадает с конфигурацией D-глицеринового альдегида, т.е., если гидроксил стоит справа, то моносахарид относится к D-ряду. Если же гидроксил стоит слева и конфигурация последнего хирального центра соответствует L-глицериновому альдегиду, то моносахарид относят к L-ряду. Принадлежность моноcахаридов к D - или L - ряду указывает только на то, что он может быть получен из D – или, соответственно, L-глицеринового альдегида. Направление вращения плоскополяризованного света растворами сахаров зависит от конфигурации всех хиральных центров, поэтому конфигурацию моносахаридов, т.е. принадлежность к тому или иному генетическому ряду, принято обозначать большими буквами, соответственно, D и L, а направление вращения - знаками: (+)-вправо, (-) –влево. Знак вращения ставится после буквенных обозначений. Почти все природные сахара относятся к D-ряду. Для написания формул моносахаридов с учетом их конфигурации используются проекционные формулы Фишера. Углеродная цепь в них записывается вертикально. В альдозах наверху помещается альдегидная группа, в кетозах - первичноспиртовая, расположенная рядом с кетонной. С них и начинается нумерация цепи. На рис. 3.4.1. показано происхождение альдоз от D-глицеринового альдегида.
 |
D-глицериновый альдегид
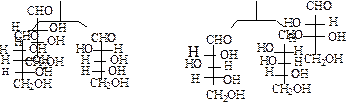 |
D-(-)эритроза D-(+)-треоза
D(-)-рибоза D-(-)-арабиноза D(+)-ксилоза D-(-)-ликсоза
 |
D(+)АллозаD(+)альтрозаD(+)глюкозаD(+)маннозаD(-)гулоза
D(-)идозаD(+)галактоза D(+)галоза
Рис.3.4.1.Семейство D - альдоз.
Все изображенные 8 D-. альдогексоз имеют одинаковую природу и последовательность связей между атомами, но отличаются конфигурацией, т.е. пространственным расположением заместителей у одного или нескольких углеродных атомов. Такие стереоизомеры называются диастереоизомерами. Частным случаем диастереомеров являются эпимеры, это диастереомеры, различаюшиеся конфигурацией только одного хирального центра (например, D-глюкоза и D -манноза являются эпимерами, так как отличаются друг от друга конфигурацией С-2). Из альдопентоз наиболее распространены в природе D-рибоза и D- 2 - дезоксирибоза, входящие в состав нуклеиновых кислот. Из кетогексоз в природе наиболее распространенным моносахаридом является D - фруктоза.
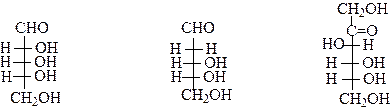 |
D-рибоза D-2-дезоксирибоза D-фруктоза
Циклические формы моносахаридов. Уже давно были известны свойства моносахаридов, которые не могли быть объяснены предложенными ранее для них формулами гидроксиальдегидов и гидроксикетонов. В частности, в водных растворах сахаров наблюдается мутаротация - изменение угла оптического вращения, моносахариды реагируют с аминами, но оснований Шиффа не дают, в некоторых реакциях наблюдается повышенная реакционная способность одной из гидроксильных групп и др Для объяснения этих противоречий было высказано предположение, впоследствии подтвердившееся, что моносахариды могут иметь двоякое строение: не только альдегидо- и кетоспиртов, но и внутренних циклических полуацеталей, не содержащих свободной альдегидной (кетонной) группы, но легко дающих ее при разрыве цикла:
 |
Образование полуацеталя в общем виде
В результате дальнейших исследований оказалось, что в кристаллическом состоянии моносахариды имеют циклическое строение, а в водных растворах представлены циклическими и открытыми оксо-формами, находящимися в динамическом равновесии. Такая таутомерия называется цикло - цепная таутомерия. Поэтому в зависимости от условий они могут реагировать и как гидроксиальдегиды или гидроксикетоны, и как полуацетали. Равновесие сдвигается в сторону той формы, которая принимает участие в реакции, и, в конечном итоге, вся молекула реагирует в одной форме. Образование циклических форм обусловлено взаимодействием карбонильной группы с гидроксилом пятого (С-5) или (С-4) углеродного атома. Эти атомы из-за конфигурации углеродной цепи могут сближаться друг с другом в пространстве без возникновения углового напряжения. Такие превращения характерны не только для моносахаридов. За счет внутримолекулярного взаимодействия по механизму нуклеофильного присоединения образуется циклический полуацеталь (полукеталь). У альдогексоз в реакцию с альдегидной группой преимущественно вступает гидроксильная группа у С-5, так как при этом образуется термодинамически устойчивый шестичленный цикл. Такой цикл называется пиранозным, а образующаяся полуацетальная гидроксильная группа - гликозидной. Если в реакцию вступает гидроксильная группа у С-4, то полуацеталь содержит пятичленный цикл, называемым фуранозным. В циклической форме (по сравнению с открытой) возникает дополнительный центр хиральности при атоме углерода, содержащего ранее карбонильную группу. Новый хиральный центр называется аномерным, а соответствующие два стереоизомеры - a, - b - аномерами. У α - аномера конфигурация аномерного центра совпадает с конфигурацией нижнего, ”ключевого”, хирального центра в молекуле моносахарида, а у β - аномера - противоположная. Таким образом, в проекционных формулах Фишера гликозидная гидроксильная группа у α - аномера расположена так же, как гидроксильная группа у нижнего хирального центра, а β- аномера - противоположно относительно вертикальной линии углеродной цепи.
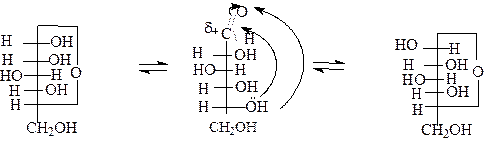
α-D-глюкопираноза D-глюкоза β-D-глюкопираноза (циклическая форма) (открытая форма) (циклическая форма)
Перспективные формулы углеводов. На проекциях Фишера циклические формы моносахаридов выглядят необычно, поэтому их изображают с помощью перспективных формул (формулами Хеуорса), в которых циклы изображаются в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом кислорода всегда изображается в правом верхнем углу для пиранозной формы, за плоскостью цикла – для фуранозной. Углеродные атомы, как правило, не пишутся, а только нумеруются. Через них проводят вертикальные линии, на концах которых пишутся гидроксильные группы (атомы водорода опускаются) в соответствии с их пространственным расположением в молекуле.
 |
Рис.3.4.2. пираноза фураноза
 |
При этом атомы и группы, находящиеся с левой стороны проекции Фишера, пишутся над плоскостью цикла, а находящиеся справа - под плоскостью, при этом гидроксильная группа при С-1 направлена “вниз” для α- аномера, и “вверх” - для β- аномера. Для D-сахаров свободную СН2ОН-группу альдогексозы изображают над плоскостью кольца:
a -D-глюкопираноза b - D-глюкопираноза.
Однако фуранозная форма также широко встречается среди моносахаридов. Пиранозная форма является предпочтительной для альдогексоз, в то время альдопентозы образуют циклические полуацетали как в фуранозной, так и пиранозной форме. Подобно альдопентозам 2-кетогексозы могут существовать в фуранозной форме. Наиболее ярким примером является D-фруктоза:
 |
α-D-фруктофураноза β - D-фруктофураноза.
Конформация моносахаридов. Формулы Хеуорса предполагают плоское строение кольца. Это приблизительно верно для фураноз. Рентгеноструктурные исследования сахаров показали, что пиранозы существуют в кресловидной конформации (аналогично конформации “кресла” для циклогексана), причем такой, в которой максимально возможное число объемистых заместителей расположено экваториально. β-D-глюкопираноза является наиболее распространенным моносахаридом и основной единицей большинства полисахаридов. Это безусловно связано с тем, что у этого аномера все заместители находятся в экваториальном положении.
 |
Рис.3.4.3. β-D-глюкопираноза в форме кресла.
Мутаротация. a - Глюкоза образует кристаллы с углом удельного вращения, равным +1120. Известна и другая глюкоза с углом удельного вращения +190(β- аномер). При растворении в воде происходит изменение угла оптического вращения обеих форм, пока оно не достигнет величины +530. Этот процесс называется мутаротацией.. Мутаротация вызвана тем, что в растворе моносахариды способны к таутомерии, т.е. к существованию в равновесии смеси открытой и циклических форм. В водных растворах устанавливается равновесие между циклическими таутомерами моносахаридов, различающихся размером цикла (фуранозный, пиранозный), конфигурацией аномерного атома (α и β-формы) и свободной карбонильной формой. Например в водном растворе глюкозы устанавливается равновесие между 5 таутомерами: a-,b- аномерами пиранозных и фуранозных циклических форм и открытой оксо-формой:
 |
D- глюкофураноза глюкоза D-глюкопираноза
(α- и β- аномеры) (открытая форма) (α- и β-аномеры)
Все сахара, содержащие полуацетальный (полукетальный) гидроксил, претерпевают в растворе мутаротацию с установлением равновесия между аномерными циклическими формами, взаимопревращение которых происходит через образование промежуточного альдегида или кетона.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1941; Нарушение авторских прав?; Мы поможем в написании вашей работы!