
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Статистический смысл энтропии. Энтропия идеального газа
|
|
|
|
Макросостояние – это состояние вещества, характеризуемое его термодинамическими параметрами.
Состояние же системы, характеризуемое состоянием каждой входящей в систему молекулы, называют микросостоянием.
Так как молекулы движутся хаотически, то имеется много микросостояний, соответствующих одному макросостоянию. Обозначим W - число микросостояний, соответствующее данному макросостоянию (как правило, W >> 1).
Термодинамической вероятностью или статистическим весом макросостояния W - называется число микросостояний, осуществляющих данное макросостояние (или число перестановок одноименных элементов, при которых сохраняется данное макросостояние).
Термодинамическая вероятность W - максимальна, когда система находится в равновесном состоянии.
В состоянии равновесия и термодинамическая вероятность максимальна, и энтропия максимальна. Из этого можно сделать вывод, что между ними существует связь.
Энтропия S – аддитивная величина:  , где
, где 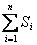 - сумма энтропий тел, входящих в систему.
- сумма энтропий тел, входящих в систему.
Вероятность сложного события, есть произведение вероятностей состояний:
 , ,
|
где W 1 – первое состояние; W 2 – второе состояние.
Аддитивной величиной является логарифм термодинамической вероятности:
 . .
|
Поэтому Л. Больцман предложил:
 , ,
| (6.7.1) |
где k – коэффициент Больцмана. С этой точки зрения энтропия выступает, как мера беспорядочности, хаотичности состояния.
Например, в ящике черные и белые шары. Они порознь, есть порядок и W невелика. После встряхивания – шары перемещаются, W увеличивается и энтропия тоже. И сколько бы не встряхивать потом ящик, никогда черные шары не соберутся у одной стенки, а белые у другой, хотя эта вероятность не равна нулю.
Связь между S и W позволяет несколько иначе сформулировать второе начало термодинамики: наиболее вероятным изменением энтропии является ее возрастание.
Энтропия – вероятностная статистическая величина. Утверждение о возрастании энтропии потеряло свою категоричность. Её увеличение вероятно, но не исключаются флуктуации.
На основе этих рассуждений Р. Клаузиус в 1867 г. и выдвинул гипотезу о тепловой смерти Вселенной (о ней сказано ранее).
Л. Больцман один из первых опроверг эту гипотезу и показал, что закон возрастания энтропии – статистический закон, т.е. возможны отклонения.
Российские физики Я.Б. Зельдович и И.Д. Новиков так же опровергли эту теорию и показали, что Р. Клаузиус не учел, что Вселенная не стационарна и в будущем не перейдет к одному состоянию, так как она эволюционирует, не остается статичной.
Энтропия замкнутой системы – максимальна, при достижении системой равновесного состояния.
20. Третье начал термодинамики. (теорема Нернета)
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры кабсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
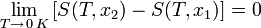
или

где x — любой термодинамический параметр.
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение):
 ,
,
третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю.
Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать в рамках классической термодинамики (на основе первого и второго начал термодинамики). В классической термодинамике энтропия может быть определена лишь с точностью до произвольной аддитивной постоянной S 0, что не мешает термодинамическим исследованиям, так как реально измеряется разность энтропий (S 0) в различных состояниях. Согласно третьему началу термодинамики, при  значение
значение  .
.
В 1911 году Макс Планк сформулировал третье начало термодинамики, как условие обращения в нуль энтропии всех тел при стремлении температуры к абсолютному нулю: 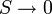 . Отсюда S 0 = 0, что даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов. Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность (W) состояния системы S = k ln W. При абсолютном нуле температуры система находится в основном квантово-механическом состоянии. Если оно невырожденно, то W = 1 (состояние реализуется единственным микрораспределением) и энтропия S при
. Отсюда S 0 = 0, что даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов. Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность (W) состояния системы S = k ln W. При абсолютном нуле температуры система находится в основном квантово-механическом состоянии. Если оно невырожденно, то W = 1 (состояние реализуется единственным микрораспределением) и энтропия S при  равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем могут стать существенными дискретность квантовых уровней макроскопической системы и влияние квантового вырождения.
равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем могут стать существенными дискретность квантовых уровней макроскопической системы и влияние квантового вырождения.
[править]Следствия
[править]Недостижимость абсолютного нуля температур
Из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достичь ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться, поэтому третье начало термодинамики иногда формулируют как принцип недостижимости абсолютного нуля температуры.
[править]Поведение термодинамических коэффициентов
Из третьего начала термодинамики вытекает ряд термодинамических следствий: при  должны стремиться к нулю теплоёмкости при постоянном давлении и при постоянном объёме, коэффициенты теплового расширения и некоторые аналогичные величины. Справедливость третьего начала термодинамики одно время подвергалась сомнению, но позже было выяснено, что все кажущиеся противоречия (ненулевое значение энтропии у ряда веществ при T = 0) связаны с метастабильными состояниями вещества, которые нельзя считать термодинамически равновесными.
должны стремиться к нулю теплоёмкости при постоянном давлении и при постоянном объёме, коэффициенты теплового расширения и некоторые аналогичные величины. Справедливость третьего начала термодинамики одно время подвергалась сомнению, но позже было выяснено, что все кажущиеся противоречия (ненулевое значение энтропии у ряда веществ при T = 0) связаны с метастабильными состояниями вещества, которые нельзя считать термодинамически равновесными.
Теорема Нернста (тепловая теорема Нернста) - утверждение, являющееся одной из формулировок третьего начала термодинамики, сформулированное Вальтером Нернстом в 1906 году как обобщение экспериментальных данных по термодинамике гальванических элементов.
Теорема Нернста утверждает, что всякий термодинамический процесс, протекающий при фиксированной температуре T в сколь угодно близкой к нулю, 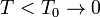 , не должен сопровождаться изменением энтропии S, то есть изотерма T = 0 совпадает с предельной адиабатой S 0.
, не должен сопровождаться изменением энтропии S, то есть изотерма T = 0 совпадает с предельной адиабатой S 0.
Макс Планк в 1910 году сформулировал более жесткое утверждение: величина S 0 была конечной и S 0 = 0. В формулировке Планка теорема Нернста имеет вид начального (граничного или предельного) условия для системы дифференциальных уравнений определяющих энтропию: При выключении температуры,  , энтропия термодинамической системы также стремится к нулю:
, энтропия термодинамической системы также стремится к нулю: 
21. Распределение молекул по скоростям (Распределение Максвела)
Распределение Ма́ксвелла — распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию. Распределение Максвелла также применимо для электронных процессов переноса и других явлений. Распределение Максвелла применимо к множеству свойств индивидуальных молекул в газе. О нём обычно думают как о распределении энергий молекул в газе, но оно может также применяться к распределению скоростей, импульсов, и модуля импульсов молекул. Также оно может быть выражено как дискретное распределение по множеству дискретных уровней энергии, или как непрерывное распределение по некоторому континууму энергии.
Распределение Максвелла может быть получено при помощи статистической механики (см. происхождение статсуммы). Как распределение энергии, оно соответствует самому вероятному распределению энергии, в столкновительно-доминируемой системе, состоящей из большого количества невзаимодействующих частиц, в которой квантовые эффекты являются незначительными. Так как взаимодействие между молекулами в газе является обычно весьма небольшим, распределение Максвелла даёт довольно хорошее приближение ситуации, существующей в газе.
Во многих других случаях, однако, даже приблизительно не выполнено условие доминирования упругих соударений над всеми другими процессами. Это верно, например, в физикеионосферы и космической плазмы, где процессы рекомбинации и столкновительного возбуждения (то есть излучательные процессы) имеют большое значение, в особенности для электронов. Предположение о применимости распределения Максвелла дало бы в этом случае не только количественно неверные результаты, но даже предотвратило бы правильное понимание физики процессов на качественном уровне. Также, в том случае где квантовая де Бройлева длина волны частиц газа не является малой по сравнению с расстоянием между частицами, будут наблюдаться отклонения от распределения Максвелла из-за квантовых эффектов.
Распределение энергии Максвелла может быть выражено как дискретное распределение энергии:
 ,
,
где  является числом молекул имеющих энергию
является числом молекул имеющих энергию 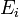 при температуре системы
при температуре системы 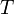 ,
, 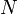 является общим числом молекул в системе и
является общим числом молекул в системе и 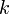 — постоянная Больцмана. (Отметьте, что иногда вышеупомянутое уравнение записывается с множителем
— постоянная Больцмана. (Отметьте, что иногда вышеупомянутое уравнение записывается с множителем 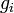 , обозначающим степень вырождения энергетических уровней. В этом случае сумма будет по всем энергиям, а не всем состояниям системы). Поскольку скорость связана с энергией, уравнение (1) может использоваться для получения связи между температурой и скоростями молекул в газе. Знаменатель в уравнении (1) известен как каноническая статистическая сумма.
, обозначающим степень вырождения энергетических уровней. В этом случае сумма будет по всем энергиям, а не всем состояниям системы). Поскольку скорость связана с энергией, уравнение (1) может использоваться для получения связи между температурой и скоростями молекул в газе. Знаменатель в уравнении (1) известен как каноническая статистическая сумма.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2310; Нарушение авторских прав?; Мы поможем в написании вашей работы!