
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атомов неметаллов 1 страница
|
|
|
|
Применение спиртов в медицине. Основным спиртом, применяющимся в медицинских целях, является этанол. Его используют в качестве наружного антисептического и раздражающего средства для приготовления компрессов и обтираний. Ещё более широко применяется этиловый спирт для приготовления различных настоек, разведений, экстрактов и прочих лекарственных форм
Парфюмерия, косметика и бытовая химия. Спирты довольно широко используются в качестве душистых веществ для составления композиций в парфюмерно-косметической промышленности и производстве отдушек для бытовой химии и прочей потребительской продукции (гераниол, нерол, цитронеллол, ментол и др.). Помимо придания аромата, в парфюмерно-косметической продукции спирты используются и в других целях
Применение в органическом синтезе: Основная доля метилового спирта используется в промышленном синтезе формальдегида методом высокотемпературного каталитического окисления метанола.Кроме того, из метанола получают трет-бутилметиловый эфир, уксусную кислоту. Из этанола в промышленности производят диэтиловый эфир.
Ароматические углеводороды являются важным сырьем для производства различных синтетических материалов, красителей, физиологически активных веществ. Так, бензол - продукт для получения красителей, медикаментов, средств защиты растений и др. Толуол используется как сырье в производстве взрывчатых веществ, фармацевтических препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется для получения полимерного материала - полистирола.
Реакции окисления: Бензол очень устойчив к действию окислителей. Обычные окислители на холоду не действуют на бензольное кольцо. Например, бензол, в отличие от непредельных углеводородов, не обесцвечивает раствор перманганата калия. Только при воздействии сильных окислителей (например, кислород воздуха при высокой температуре в присутствии V2O5) происходит разрыв бензольного кольца с образованием малеиновой кислоты
Реакции присоединения: Эти реакции не характерны для бензола, поэтому они протекают с большим трудом. Только в особых условиях (высокая температура, облучение ультрафиолетовым светом, катализатор) бензол проявляет слабо выраженный непредельный характер и может присоединять водород и галогены.
Химические свойства бензола: Из химических свойств ароматических соединений следует особенно отметить реакции замещения, а также некоторые реакции присоединения, протекающие в особых условиях, и реакции окисления.
Реакции замещения: Первой стадией электрофильного замещения является образование π-комплекса в результате взаимодействия π-электронной системы бензольного кольца с положительно заряженной частицей Х+…. В т о р а я с т а д и я состоит в переходе π-комплекса в s-комплекс. Это происходит в результате выделения из системы шести π-электронов двух электронов для образования новой ковалентной связи С—X….Т р е т ь я с т а дия – быстрое отщепление протона от s-комплекса.
Галогенирование: В зависимости от условий проведения реакции галогенирования могут получаться галогенопроизводные с атомом галогена в ядре или боковой цепи. Различают моно-, ди-, три- и полигалогенопроизводные.
12. Применение аренов
Применение:
13. Классификация спиртов.
Спирты́ — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящимся в состоянии sp³-гибридизации) атомом углерода. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
Спирты классифицируются следующим образом:
- По числу гидроксильных групп: одноатомные спирты (метанол); двухатомные спирты (этиленгликоль); трехатомные спирты (глицерин); четырёхатомные спирты (пентаэритрит); многоатомные спирты (пятиатомный спирт: ксилит).
- В зависимости от насыщенности углеводородного заместителя: предельные (насыщенные) спирты (бутанол); непредельные (ненасыщенные) спирты (аллиловый спирт, пропаргиловый спирт); ароматические спирты (бензиловый спирт).
-В зависимости от наличия или отсутствия цикла в углеводородном заместителе: ациклические (алифатические) спирты (этанол); алициклические спирты (циклогексанол).
-В зависимости от числа заместителей при α-углеродном атоме: первичные спирты (этанол); вторичные спирты (пропанол-2); третичные спирты (2-метилпропанол-2).
14. Общая характеристика спиртов (определение, гомологический ряд).
Спирты́ — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным атомом углерода. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
Спирты представляют собой обширный и разнообразный класс соединений: они весьма распространены в природе и часто выполняют важные функции в живых организмах. Спирты являются важными соединениями с точки зрения органического синтеза, не только представляя интерес как целевые продукты, но и как промежуточные вещества, имеющие ряд уникальных химических свойств.
Гомологич. Ряд. -Насыщенные одноатомные спирты образуют гомологический ряд. Общая формула спиртов этого ряда CnH2n +1 OH. Возглавляет гомологический ряд насыщенных одноатомных спиртов метанол (или метиловый спирт) CH3OH. Второй член гомологического ряда насыщенных одноатомных спиртов - этанол (или этиловый спирт) C2H5OH. Следующий за ним - пропанол (или пропиловый спирт) C3H7OH, бутанол (или бутиловый спирт) C4H9OH
15. Номенклатура спиртов.
Систематическая номенклатура: По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.
Правила построения названий спиртов: 1. Выбирают родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей гидроксильную группу. Он формирует базовое название (по числу атомов углерода).
2. Родительский углеводород нумеруют в таком направлении, чтобы гидроксильная группа получила наименьший номер в названии. (Если в соединении имеются функциональные группы старше гидроксильной, то это правило применяется к старшей функциональной группе.)3. Старшая функциональная группа обозначается в виде суффикса (для гидроксильной — -ол), а остальные заместители — в виде приставок в алфавитном порядке. Их положение в углеводородной цепи обозначается при помощи цифр — локантов, помещаемых после суффиксов и перед приставками. Для многоатомных спиртов перед суффиксом -ол указывается число гидроксильных групп (-диол, -триол, -тетраол и т. д.).
4. Если при различных вариантах нумерации цепи гидроксильная группа получает один и тот же локант, то цепь нумеруют в том направлении, при котором другой заместитель получает наименьший локант.
16. Изомерия аренов.
Определяется числом заместителей, их расположением в бензольном кольце и возможностью изомерии углеродного скелета в заместителях, содержащих более трёх атомов углерода.
Для ароматического углеводорода С8Н10 существуют 4 изомера: орто-, мета- и пара-ксилолы и этилбензол.

17. Теория А.М. Бутлерова.
1. Атомы в молекулах веществ соединены согласно их валентности. Углерод ворганических соединениях всегда четырехвалентен, а его атомы способнысоединяться друг с другом, образуя различные цепи.
Очевидно, что последнюю часть первого положения теории легко объяснитьтем, что в соединениях атомы углерода находятся в возбужденном состоянии.
2. Свойства веществ определяются не только их качественным иколичественным составом, но и порядком соединения атомов в молекуле, т.е. химическим строением вещества.
Это положение объясняет явление изомерии. Вещества, имеющиеодинаковый состав, но разное химическое или пространственное строение, аследовательно, и разные свойства, называют изомерами.
3. Свойства органических соединений зависят не только от состава вещества ипорядка соединения атомов в его молекуле, но и от взаимного влиянияатомов и групп атомов друг на друга. (Наибольшее влияние оказываютатомы, непосредственно связанные друг с другом. Влияние атомов или группатомов, не связанных непосредственно, ослабевает по мере их удаления другот друга)
18. Физико-химические свойства спиртов.
Физические св. - Молекулы спиртов, подобно молекуле воды, имеют угловое строение. Угол R−O−H в молекуле метанола равен 108,5°. Атом кислородагидроксильной группы находится в состоянии sp ³-гибридизации. Спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений. Так, из ряда монозамещённых производных метана, метанол имеет необычно высокую температуру кипения, несмотря на относительно небольшую молекулярную массу. Высокие температуры кипения спиртов объясняются наличием межмолекулярных водородных связей
Химические св.- это химические реакции спиртов во взаимодействии с другими веществами.
Они определяются в основном наличием гидроксильной группы и строением углеводородной цепи, а также их взаимным влиянием:
- Чем больше углеводородная цепь, тем сильнее она влияет на функциональную группу, снижая полярность связи O—Н. Реакции, основанные на разрыве этой связи, протекают медленнее.
- Гидроксильная группа −ОН уменьшает электронную плотность вдоль прилегающих σ-связей углеродной цепи (отрицательный индуктивный эффект).
Все химические реакции спиртов можно разделить на три условные группы, связанные с определёнными реакционными центрами и химическими связями:
Разрыв связи O−H (реакционный центр — водород);
Разрыв или присоединение по связи С−OH (реакционный центр — кислород);
Разрыв связи −СOH (реакционный центр — углерод).
19. Применение спиртов.
Экономическое значение: Области использования спиртов многочисленны и разнообразны, особенно учитывая широчайший спектр соединений, относящихся к этому классу. Вместе с тем, с промышленной точки зрения, только небольшой ряд спиртов вносит заметный вклад в глобальную мировую экономику.Самым распространённым и используемым спиртом в мире является этанол.
Применение в качестве топлива: для топливных целей в настоящий момент используются в промышленных объёмах три спирта: метанол, этанол и бутанол-1, что связано, прежде всего, с их коммерческой доступностью и возможностью массового производства из растительного сырья (кроме метанола). При этом возможно использование спиртов в виде горючего в чистом виде, в виде различных смесей с бензином или дизельным топливом, а также в качестве оксигенирующих добавок (до 10 %) с целью повышения октанового числа и снижения токсичности отработанных газов. Преобладающим топливным спиртом является этанол.
Промышленное применение спиртов: Растворители. Среди растворителей широкое распространение имеют самые разные типы спиртов: одноатомные (метанол, пропанол-2) и многоатомные (этиленгликоль, глицерин); алифатические (этанол, бутанол-1) и циклические (циклогексанол). Спирты относятся к полярным растворителям и применяются в различных отраслях промышленности. Поверхностно-активные и моющие вещества. Важнейшим сырьём в производстве современных поверхностно-активных веществ (ПАВ) для синтетических моющих средств являются высшие жирные спирты, из которых в зависимости от реагента получают неионогенные или анионные ПАВ. Гидравлические жидкости и смазочные материалы. Для получения негорючих гидравлических жидкостей применяют водные растворы, содержащие глицерин и этанол. В производстве тормозных жидкостей широко используют этиленгликоль и эфиры на его основе. Многие современные смазочные материалы имеют в своём составе высшие жирные спирты и их эфиры, благодаря их низкой токсичности, высокой температуре вспышки и бесследному испарению при нагревании. Эти свойства используются для бытового применения, а также для случаев, когда эффект охлаждения поверхности более важен, чем антифрикционные свойства (например, при сверлении, пилении или другой слесарной обработке металлов) Пищевая промышленность. Основой всех алкогольных напитков является этанол, который получается при сбраживании пищевого сырья — винограда, картофеля, пшеницы и прочих крахмало- или сахаросодержащих продуктов. Кроме того, этиловый спирт используется в качестве компонента некоторых пищевых и ароматических эссенций (ароматизаторов), широко используемых в кулинарии, при выпечке кондитерских изделий, производстве шоколада, конфет, напитков, мороженного, варений, желе, джемов, конфитюров и пр. Однако этанолом список спиртов, используемых в индустрии продуктов питания, не ограничивается.
20. Многоатомные спирты: классификация и номенклатура.:
Двухатомные спирты называются гликолями, трехатомные – глицеринами. По международной заместительной номенклатуре двухатомные спирты называются алкандиолами, трехатомные – алкантриолами. Спирты с двумя гидроксилами при одном углеродном атоме обычно в свободном виде не существуют; при попытках получить их они разлагаются, выделяя воду и превращаясь в соединение с карбонильной группой – альдегиды или кетоны.
Номенклатура. Для одноатомных спиртов: общее название: название R + “-ол” (метанол)
1. Углеродная цепь нумеруется с того края, к которому ближе -OH группа
2. Положение -OH группы указывается после окончания “- ол”
3. “Внутри”радикала правила номенклатуры те же, что и в углеводородах
название радикала + “-овый” + “спирт”
(метиловый спирт, бутиловый спирт, изобутиловый спирт)
Для многоатомных спиртов: положение -OH групп + “-ди” + ”три”… + “-ол”
Классификация. 1.двухатомные.2.трёхатомные.3.многоатомные.
21. Качественные реакции на многоатомные спирты.
Качественная реакция на многоатомные спирты - это реакция на Cu(OH)2 - образуются глицераты, васильковый раствор.
1. CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
2. HOCH2—(CHOH)4—CHO + Cu(OH)2 ---> (t)HOCH2—(CHOH)4—COOH + Cu2O + 2H2O
3. Реакция с гидроксидом меди (II) является качественной реакцией на альдегидную группу, потому сахароза, не содержащая альдегидных групп (в отличие от глюкозы и фруктозы, из фрагментов которых состоит молекула сахарозы), не реагирует с гидроксидом меди и не обладает восстановительными свойствами.
4. Качественная реакция на сахарозу:
C12H22O11(сахароза) + H2O ---> [H+](над стрелкой) C6H12O6(глюкоза) + C6H12O6(фруктоза)
Сахароза не дает реакции «серебряного зеркала» и не обладает восстановительными свойствами. В этом ее отличие от глюкозы.
Качественная реакция на глюкозу (обладает свойствами альдегидов):
а) реакция "серебряного зеркала". Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.
СН2ОН – (СНОН) 4 – СОН + Ag2O = СН2ОН – (СНОН) 4 – СООН + 2AgU95;
глюконовая кислота
б) реакция с гидроксидом меди (II):
HOCH2—(CHOH)4—CHO + Cu(OH)2 --->(t) HOCH2—(CHOH)4—COOH + Cu2O + 2H2O
Качественная реакция на крахмал:
с йодом возникает синее окрашивание.
22. Качественные реакции на непредельные углеводороды.
А)-реакция с бромом,
б)-реакция с водой,
в-)реакция с хлором,
г)- реакция горения
23. Применение многоатомных спиртов.

24. Правило Марковникова.
При ионном присоединении галогеноводорода к двойной углерод-углеродной связи несимметричного алкена водород присоединяется к тому атому углерода при двойной связи, с которым соединено больше водородных атомов, а атом галогена – к тому атому углерода, где их меньше.
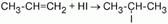
Влиянием метильного радикала на двойную связь и обусловливается тот факт, что присоединение идет не произвольно, а в определенном направлении.
Атом углерода смещает в свою сторону электронную плотность связей с атомами водорода и приобретает частичный отрицательный заряд. Электронная плотность связи радикала с соседним атомом углерода смещается в сторону последнего, а это образует смещение весьма подвижного облака?-связи к крайнему атому углерода.
25. Реакция полимеризации.
Особенности реакции полимеризации:
1) полимеризация – это последовательное соединение одинаковых молекул в более крупные;
2) реакции полимеризации особенно характерны для непредельных соединений:
а) из этилена образуется высокомолекулярное вещество – полиэтилен;
б) соединение молекул этилена происходит по месту разрыва двойной связи:
nСН2=СН2? (-СН2-СН2-)n;
3) к концам таких молекул (макромолекул) присоединяются какие-нибудь свободные атомы или радикалы (например, атомы водорода из этилена);
4) продукт реакции полимеризации называется полимером (от греческого поли – много, мерос – часть);
5) исходное вещество, которое вступает в реакцию полимеризации, называется мономером.
Условия протекания реакций полимеризации весьма различны:
1) в некоторых случаях необходимы катализаторы и высокое давление;
2) главным фактором является строение молекулы мономера;
3) в реакцию полимеризации вступают непредельные (ненасыщенные) соединения за счет взрыва кратных связей.
В лабораторных условиях полиэтилен получают при нагревании этилового спирта с водоотнимающими веществами (концентрированной серной кислотой, оксидом фосфора (v) и другими): С2Н5ОН? СН2=СН2 + Н2О.
26. Реакция поликонденсации.
Поликонденсация – это процесс образования высокомолекулярных соединений из низкомолекулярных, который сопровождается выделением побочного вещества (воды, аммиака, хлороводорода и других веществ).
1) при полимеризации, в отличие от поликонденсации, выделения побочных веществ не происходит;
2) продукты поликонденсации (исключая побочные вещества) так же, как и продукты полимеризации, называются полимерами;
3) при реакции поликонденсации цепь растет постепенно: сначала взаимодействуют между собой исходные мономеры, далее образовавшиеся соединения поочередно реагируют с молекулами тех же мономеров, образуя в итоге полимерное соединение. Примером реакции поликонденсации может служить образование фенолоформальдегидных смол, которые употребляются для изготовления пластических масс;
4) реакция протекает при нагревании в присутствии катализатора (кислоты или щелочи);
5) в молекуле фенола атомы водорода подвижны, а карбонильная группа альдегида способна к реакциям присоединения, при этом фенол и формальдегид взаимодействуют между собой;
6) образовавшееся соединение взаимодействует далее с фенолом с выделением молекулы воды;
7) новое соединение взаимодействует с формальдегидом;
8) это соединение конденсируется с фенолом, затем снова с формальдегидом и т. д.;
9) в результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолоформальдегидные смолы.
27. Общая характеристика карбоновых кислот (понятие гомологического ряда).
КАРБОНОВЫЕ КИСЛОТЫ - органические соединения, содержащие одну или несколько карбоксильных групп — СООН. Известны одноосновные карбоновые кислоты RCOOH (уксусная, бензойная), двухосновные R(COOH)2 (щавелевая, фталевая) и многоосновные
(лимонная) (R — органический радикал).
Гомологический ряд предельных карбоновых кислот начинается муравьиной кислотой. Систематические названия кислот образуются, путем прибавления к названию углеводорода с соответствующим числом углеродных атомов окончания - овая и слова кислота. В ряду карбоновых кислот весьма широкое применение находят тривиальные названия: муравьиная, уксусная, масляная, валериановая, капроновая кислоты.
Карбоксильная группа является одной из наиболее старших среди функциональных групп в органических молекулах. Поэтому в названиях замещенных кислот следует указывать положение заместителя цифрой, причем первый номер имеет атом углерода в составе карбоксила (официальная номенклатура). Альтернативный вариант нумерации подразумевает использование букв греческого алфавита, причем карбоксильный атом углерода не считается, а первый атом радикала обозначают буквой a (тривиальная номенклатура). Для алифатических кислот наблюдается изомерия скелета (нормальная цепь, разветвленная цепь) и оптическая изомерия.
карбоновая кислота карбоксил спирт
Карбоксил может быть соединен также с непредельным радикалом. Для непредельных кислот, кроме вышеперечисленных видов, имеет место также E, Z-изомерия.
Ароматические карбоновые кислоты называют как производные бензойной кислоты, либо кислот других ароматических систем.
28. Физико-химические свойства карбоновых кислот.
Химические свойства. -Карбоновые кислоты — более сильные кислоты, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью благодаря влиянию группы СО. В водном растворе карбоновые кислоты диссоциируют:
RCOOH  RCOO- + Н+
RCOO- + Н+
Тем не менее из-за ковалентного характера молекул карбоновых кислот указанное выше равновесие диссоциации достаточно сильно сдвинуто влево. Таким образом, карбоновые кислоты — это, как правило, слабые кислоты. Например, этановая (уксусная) кислота характеризуется константой диссоциации Ка = 1,7*10-5.
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индуктивного эффекта. Такие заместители, как хлор или фенильный радикал оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индуктивный эффект. Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты. В отличие от этого такие заместители, как алкильные группы, обладают электронодонорными свойствами и создают положительный индуктивный эффект, +I. Они понижают кислотность. Влияние заместителей на кислотность карбоновых кислот наглядно проявляется в значениях констант диссоциации Ka для ряда кислот. Кроме того, на силу кислоты оказывает влияние наличие сопряженной кратной связи.
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот
3. Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную либо арильную группу. Хотя нитрилы имеют другую общую формулу (R—CN), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот.
Физические св.- Низшие кислоты с числом атомов углерода до 3 - легкоподвижные бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот с 4-9 атомами углерода - маслянистые жидкости с неприятным запахом. Кислоты с большим количеством атомов углерода - твёрдые вещества, нерастворимые в воде. Плотность муравьиной и уксусной кислот больше единицы, остальных - меньше. Температура кипения возрастает по мере увеличения молекулярной массы, при одном и том же числе углеродных атомов кислоты нормального строения кипят при более высокой температуре, чем кислоты изостроения. Карбоновые кислоты кипят при значительно более высоких температурах, чем спирты. Их молекулы ассоциированы намного сильнее вследствие того что связи  в них в большей степени поляризованы по типу
в них в большей степени поляризованы по типу 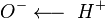 . Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы.
. Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы.
29. Номенклатура карбоновых кислот.
По международной номенклатуре ИЮПАК, карбоновые кислоты называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание " овая " и слово " кислота ". При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН - пропановая кислота, СН3-С(СН3)2-СООН - 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание " карбоновая " и слово " кислота ", не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН - циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН - трет -бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия.
30. Качественные реакции на альдегидную группу.
Одна из самых интересных качественных реакций в органической химии — на альдегиды, предназначена исключительно для выявления соединений, содержащих альдегидную группу. К альдегиду приливают аммиачный раствор оксида серебра, реакция идет при нагревании:
CH3-CHO + 2[Ag(NH3)2]OH —t—> CH3-COOH + 2Ag↓ + 4NH3↑ + H2O
Если опыт проведен грамотно, то выделяющееся серебро покрывает колбу ровным слоем, создавая эффект зеркала. Именно поэтому реакция называется реакцией серебряного зеркала.
Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
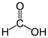
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
HCOOH + 2[Ag(NH3)2]OH —t—> CO2↑ + 2H2O + 4NH3↑ + 2Ag↓
Помимо реакции серебряного зеркала существует также реакция с гидроксидом меди (II) Cu(OH)2. Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CuSO4 + 2NaOH ——> Na2SO4 + Cu(OH)2↓
CH3-CHO + 2Cu(OH)2 —t—> CH3-COOH + Cu2O↓ + 2H2O
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
Еще один метод определения альдегидов — реакция с щелочным раствором тетраиодомеркурата (II) калия, известный нам из предыдущей статьи как реактив Несслера:
CH3-CHO + K2[HgI4] + 3KOH ——> CH3-COOK + Hg↓ + 4KI + 2H2O
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
31. Простые эфиры (характеристика).
ростые эфиры представляют собой органические вещества, в которых молекулы содержат углеводородные радикалы, соединенные атомом кислорода. Записать это можно следующим образом: R'–O–R", где R" и R' являются одинаковыми или различными радикалами. Простые эфиры рассматриваются в качестве производных спиртов. Эти соединения имеют составные названия. При этом используется название радикалов (по возрастанию молекулярной массы) и, собственно, слово "эфир" (диметиловый эфир СН3ОСН3, метилэтиловый эфир С2Н5ОСН3.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 937; Нарушение авторских прав?; Мы поможем в написании вашей работы!