
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атомов неметаллов 2 страница
|
|
|
|
32 Сложные эфиры. Реакция этерификации.
Эфиры сложные, органические соединения, производные кислот, в молекулах которых гидроксильная группа OH замещена на остаток спирта, енола или фенола — OR,.. Э. с. являются структурными аналогами солей кислородных кислот: вместо атома металла в Э. с. находится углеводородный радикал R. Отсюда и сходная номенклатура, например натрия ацетат NaOCOCH3 иэтилацетат C2H5OCOCH3. Подобно солям, Э. с. образуют с двух- и многоосновными кислотами продукты неполного и полного замещения: соответственно кислые эфиры, например монометилсульфат HOSO2OCH3, и полные, или средние, эфиры, например диметилсульфат CH3OSO2OCH3. Однако по свойствам Э. с. существенно отличаются от солей; это типичные органические соединения: обычно жидкие летучие вещества, в некоторых случаях обладающие фруктовым или цветочным запахом, практически нерастворимые в воде, хорошо растворимые в органических растворителях. Под действием воды Э. с. подвергаются гидролизу с образованием соответствующих спирта и кислоты, например RCOOR' + H20 Û RCOOH + HOR’. Эта реакция ускоряется кислотами и ещё эффективнее — щелочами. В последнем случае образуются не свободные кислоты, а их соли и реакция становится необратимой. Из других реакций, в которых Э. с. проявляют ацилирующие свойства, наиболее известны переэтерификация, алкоголиз, реакции двойного обмена. Некоторые Э. с., например образованные низшими алифатическими спиртами и такими кислотами, как серная, трифторуксусная, фосфорная, фталевая, обладают также алкилирующими свойствами (см. Алкилирование, Диметилсульфат, Этилсерная кислота). Получают Э. с., как правило,этерификацией, а также ацилированием спиртов различными производными кислот (галогенангидридами, ангидридами), действием солей кислот на алкилгалогениды
Этерификация — реакция образования сложных эфиров при взаимодействии кислот и спиртов:
RCOOH + R’OH ⇔ RCOOR' + Н2О
Реакция протекает в условиях кислотного катализа и проходит по механизму нуклеофильного замещения. На первой стадии происходит протонирование атома кислорода карбонильной группы карбоновой кислоты с образованием резонансно стабилизированного карбкатиона
Этерификацию обычно проводят в присутствии катализаторов — сильных кислот (серная кислота, толуолсульфоновая кислота и т. п.).
Реакция этерификации обратима (гидролиз сложных эфиров называется омылением), положение равновесия зависит от строения и концентраций спирта и карбоновой кислоты, то есть для реакционной смеси существует предел этерификации, при котором устанавливается равновесие, характеризующееся определенным соотношением концентраций исходных спирта и кислоты и продукта их реакции — сложного эфира. Так, например, при эквимолярном соотношении этанола и уксусной кислоты в исходной реакционной смеси равновесие устанавливается, когда ~2/3 спирта и кислоты прореагируют с образованием этилацетата.
Для повышения выхода сложного эфира используют либо избыток одного из реагентов (обычно спирта), либо отгонку образующейся при этерификации воды в видеазеотропной смеси с добавляемым в реакционную смесь бензолом.
33. Твердые жиры.
Жиры-это сложные эфиры образованные глицирином и высшим карбоновыми кислотами.
В состав твёрдых жиров- входят триглицириды с остатками предельных кислот …они представляют собой твёрдые жиры (животные жиры)
34. Жидкие жиры.
Жиры-это сложные эфиры образованные глицирином и высшим карбоновыми кислотами.
В состав жидких жиров- входят остатки непредельных карбоновых кислот (сливочное масло в исключении) их называют маслами и относят к растительным жирам.
Жидкие жиры подвергаются отверждения или гидродинизации- это взоимодействие непредельный остатков карбоновых кислот с водородом при этом кратные связи рвутся и переходят в непредельные продукты (Сало-масло)
35.Реакция Омыления
Омыление — это расщепление сложного эфира с образованием спирта и соли (или органической кислоты). При омылении жиров, представляющих собой эфиры высших жирных кислот и глицерина, щелочами образуются соли жирных кислот, называемые мылами (отсюда и происхождение термина «омыление»).
Реакция омыления обратна реакции этерификации — образованию сложного эфира из спирта и кислоты. При О. разрывается связь между атомом кислорода эфира и атомом углерода карбонильной группы. В промышленности широко используют О. природных жиров щелочами при повышенной температуре, в результате которого образуются соли высокомолекулярных жирных кислот — мыла (отсюда и название О.). Омыление сложных эфиров имеет большое значение в биологическом обмене веществ. Оно происходит под действием соответствующих ферментов — эстераз.
36. Отверждение жиров. Сало-масла.
Жидкие жиры подвергаются отверждения или гидродинизации- это взоимодействие непредельный остатков карбоновых кислот с водородом при этом кратные связи рвутся и переходят в непредельные продукты (Сало-масла)
37.Виды гибридизации
Внутривидовая-скрещивание происходит между одним и тем же видом
,Межвидовое скрещивание- скрещивание просхидит между разными видами,сортами.
38.Понятие гибридизация
Гибридизация — процесс образования или получения гибридов, в основе которого лежит объединение генетического материала разных клеток в одной клетке.
39.Электронное строение атома
Атом состоит из положительно заряженного ядра, окруженного облаком отрицательно заряженных электронов. Размеры атома в целом определяются размерами его электронного облака и велики по сравнению с размерами ядра (линейные размеры атома ~ 10~8см, его ядра ~ 10" -10" 13 см). Электронное облако атома не имеет строго определенных границ, поэтому размеры атома в значительной степени условны и зависят от способов их определения. Ядро атома состоит из Z протонов и N нейтронов, удерживаемых ядерными силами. Положит. заряд протона и отрицат. заряд электрона одинаковы по абсолютной величине и равны е= 1,60*10-19 Кл; нейтрон не обладает электрическим зарядом. Заряд ядра +Ze - основная характеристика атома, обусловливающая его принадлежность к определенному химическому элементу. Порядковый номер элемента в периодической системе Менделеева (атомный номер) равен числу протонов в ядре.
40. Электронная схема строения атома.

41.Электронная формула строения атома

.s.p.d
42.Электронно-графическая формула атома
Электронно-графическая формула для отдельных атомов химических элементов – это расположение всех его электронов на орбиталях. В такой формуле все электроны помечаются стрелочками, а квадратиками – орбитали.
пример:

43. Классификация минеральных соединений.
Все неорганические соединения делятся на две большие группы:
Простые вещества — состоят из атомов одного элемента;
Сложные вещества — состоят из атомов двух или более элементов.
Простые вещества по химическим свойствам делятся на:
металлы(Li,Na, K, Mg, Ca и др.);
неметаллы(F2, Cl2,O2, S, P и др.);амфотерные простые вещества (Zn, Al, Fe, Mn и др.);
благородные газы(He,Ne, Ar, Kr, Xe, Rn).
Сложные вещества по химическим свойствам делятся на:
оксиды:
осно́вные оксиды(CaO,Na2Oи др.);
кислотные оксиды(CO2, SO3 и др.);
амфотерные оксиды(ZnO, Al2O3 и др.);
двойные оксиды(Fe3O4 и др.);
несолеобразующие оксиды(CO,NOи др.);
Гидроксиды;
основания (NaOH, Ca(OH)2 и др.);
кислоты(H2SO4,HNO3 и др.);
амфотерные гидроксиды(Zn(OH)2, Al(OH)3 и др.);
соли:
средние соли (Na2SO4, Ca3(PO4)2 и др.);
кислые соли (NaHSO3, CaHPO4 и др.);
осно́вные соли (Cu2CO3(OH)2 и др.);
двойные и/или комплексные соли (CaMg(CO3)2, K3[Fe(CN)6], KFeIII[FeII(CN)6] и др.);
бинарные соединения:
бескислородные кислоты(HCl,H2S и др.);
бескислородные соли (NaCl, CaF2 и др.);
прочие бинарные соединения (AlH3, CaC2, CS2 и др.)
44 Классификация оксидов
.По химическим свойствам оксиды подразделяют на следующие типы:
основные — им соответствуют основания;
амфотерные — им соответствуют амфотерные гидроксиды, которые соче-тают свойства оснований и кислот;
кислотные — им соответствуют кислоты;
несолеобразующие или безразличные— они не имеют своих гидроксидов и не вступают в реакции обмена (запомните их формулы: N2О, NO, CO, SiO и др.);
вода — занимает особое положение, по своим свойствам она является од-новременно и амфотерным, и несолёобразующим оксидом.
45. Классификация кислот
Кроме подразделения на кислоты Льюиса и кислоты Брёнстеда, последние принято классифицировать по различным формальным признакам:
· По содержанию атомов кислорода:
· бескислородные (HCl, H2S);
· кислородсодержащие (HNO3, H2SO4).
· По количеству кислых атомов водорода:
· одноосновные (HNO3);
· двухосновные (H2SeO4);
· трёхосновные (H3PO4, H3BO3);
· многоосновные.
· По силе
· Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
· Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
· По устойчивости
· Устойчивые (H2SO4);
· Неустойчивые (H2CO3).
· По принадлежности к классам химических соединений
· Неорганические (HBr);
· Органические (HCOOH,CH3COOH);
· По летучести
· Летучие (HNO3,H2S, HCl);
· Нелетучие (H2SO4);
· По растворимости в воде
· Растворимые (H2SO4);
· Нерастворимые (H2SiO3);
46.Классификация солей
соли делятся на средние, кислые, основные, двойные и комплексные
Средние (нормальные) соли — продукты замещения всех катионов водорода в молекулах кислоты на катионы металла (Na2CO3, K3PO4).
Кислые соли — продукты частичного замещения катионов водорода в кислотах на катионы металла (NaHCO3, K2HPO4). Они образуются при нейтрализации основания избытком кислоты (то есть в условиях недостатка основания или избытка кислоты).
Осно́вные соли — продукты неполного замещения гидроксогрупп основания (OH) кислотными остатками ((CuOH)2CO3). Они образуются в условиях избытка основания или недостатка кислоты.
Двойные соли — соли, содержащие два различных катиона (KAl(SO4)2·12 H2O).
47.номенклатура оксидов
Общая формула оксидов ЭmOn, где m – число атомов элемента, n – число атомов кислорода
Согласно международной номенклатуре названия оксидов образуются из латинского корня названия элемента с большей электроотрицательностью с окончанием -ид и русского названия элемента с меньшей электроотрицательностью в родительном падеже. Если элемент образует несколько оксидов, то в их названиях указывается степень окисления элемента римской цифрой в скобках сразу после названия, допускается также использовать латинские приставки для указания количества элементов, входящих в молекулу оксида.
Например: Na2O – оксид натрия или оксид динатрия;
48.Номенклатура кислот
Общая формула кислот HnAc, где n – число атомов водорода, равное заряду иона кислотного остатка, Ac – кислотный остаток.
Названия кислородных кислот образуются от названия элемента с прибавлением окончаний -ная, -вая, если степень окисления его соответствует номеру группы короткой формы Периодической системы, и слова «кислота». По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например, HCl+7O4 – хлорная кислота,
HCl+5O3 – хлорноватая кислота,
HCl+3O2 – хлористая кислота,
HCl+1O – хлорноватистая кислота.
49. Номенклатура оснований.
.Основания называются следующим образом: сначала произносят слово «гидроксид», а затем металл, который его образует. Если металл имеет переменную валентность, то она указывается в названии.
КОН – гидроксид калия;
Ca(OH)2 – гидроксид кальция;
Fe(OH)2 – гидроксид железа (II);
Fe(OH)3 – гидроксид железа (III);
50.номенклатура солей бескислородных кислот

61. Растворимость произведения растворимости.
Насыщенный раствор образуется в том случае, когда растворяемое вещество больше уже не может растворяться в нем. Если растворяемое вещество представляет собой ионное соединение, то ионы в насыщенном растворе находятся в динамическом равновесии с избыточным, нерастворившимся твердым веществом. Например, в насыщенном растворе хлорида серебра устанавливается следующее равновесие:
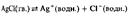
Константа этого равновесия определяется выражением 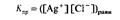
62. Водородный потенциал растворов.
Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
63. Краткая характеристика металлов.
Металлами называют такие вещества, среди свойств которых есть высокая прочность, теплопроводность и электропроводность, пластичность и специфический блеск, который еще называют металлическим. В природе металлы составляют три четверти всех существующих элементов. Но в строительстве применяются далеко не все металлы. Некоторые металлы довольно редко можно встретить. Немного металлов в неограниченном количестве содержатся в земной коре. Но они очень важны для строительства и для техники. Этот материал в строительстве применяется как металлопрокат и как металлические изделия. Из металла делаются пневматические винтовки crosman. Металлы бывают цветные и черные.
64. Краткая характеристика неметаллов.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов. Особенно сильные окислительные свойства, т. е. способность присоединять электроны, проявляют неметаллы, находящиеся во 2-ом и 3-м периодах VI-VII групп. Неметаллы могут образовывать соединения с разными внутримолекулярными связями.
50.номенклатура солей бескислородных кислот

51. Номенклатура солей кислородсодержащих кислот
Традиционные названия солей состоят из названий анионов в именительном падеже и названий катионов в родительном падеже. Названия анионов строятся на основе русских или латинских названий кислотообразующих элементов. Если кислотообразующий элемент может иметь одну степень окисления, то к его названию добавляют суффикс -ат:
CO32- — карбонат,
GeO32- — германат.
Если кислотообразующий элемент может принимать две степени окисления, то для аниона, образованного этим элементом в более высокой степени окисления, применяют суффикс -ат, а для аниона с элементов в меньшей степени окисления — суффикс -ит:
SO42- — сульфат,
SO32- — сульфит.
Если элемент может принимать три степени окисления, то для высшей, средней и низшей степени окисления используют соответственно суффиксы -ат, -ит и суффикс -ит с приставкой гипо-:
NO3- — нитрат,
NO2- — нитрит,
NO22- — гипонитрит.
Наконец, в случае элементов, принимающих четыре степени окисления, для высшей степени окисления применяют приставку пер- и суффикс -ат, далее (в порядке понижения степени окисления) суффикс -ат, суффикс -ит и суффикс -ит с приставкой гипо-:
ClO4- — перхлорат,
ClO3- — хлорат,
ClO2- — хлорит,
ClO- — гипохлорит.
Приставки мета-, орто-, поли-, ди-, три-, пероксо- и т. п., традиционно присутствующие в названиях кислот, сохраняются также и в названиях анионов.
Названия катионов соответствуют названиям элементов, от которых они образованы: при необходимости указывается число атомов в катионе (катион диртути(2+) Hg22+, катион тетрамышьяка(2+) As42+) и степень окисления атома, если она переменная.
Названия кислых солей образуются путём добавления приставки гидро- к названию аниона. Если на один анион приходится больше одного атома водорода, то его количество указывают при помощи умножающей приставки (NaHCO3 — гидрокарбонат натрия, NaH2PO4 — дигидрофосфат натрия). Аналогично, для образования названий основных солей используются приставки гидроксо- ((FeOH)NO3 — гидроксонитрат железа(II))[13].
Кристаллогидратам дают названия, добавляя слово гидрат к традиционному или систематическому названию соли (Pb(BrO3)2·H2O — гидрат бромата свинца(II), Na2CO3·10 H2O — декагидрат карбоната натрия). Если известна структура кристаллогидрата, то может применяться номенклатура комплексных соединений ([Be(H2O)4]SO4 — сульфат тетрааквабериллия(II)).
52. Взаимодействие классов минеральных веществ между собой.
Вероятность взаимодействия между минеральными веществами вследствие их лабильности и способности к образованию связей значительно больше, чем между другими питательными веществами.
53 .Строение комплексов
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером.В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определённое число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы. Таким нейтральным комплексом является, например, [Pt(NH3)2Cl2].
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой — между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония. Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счёт неподеленных электронных пар комплексообразователя и свободных орбиталей лигандов.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы.
При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава.
54. Номенклатура комплексов
1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион.
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Примеры:
K3[Fe(CN)6] — гексацианоферрат(III) калия
55. ОВР: понятие восстановления, окисления, восстановитель, окислитель.
Восстановление- процесс, в результате которого частица (атом, ион или молекула) принимает один или несколько электронов;
происходит понижение степени окисления какого-либо атома в данной частице;
органическое вещество теряет атомы кислорода и (или) приобретает атомы водорода.
Окисление- это процесс, при котором происходит переход электронов от восстановителя, который сам при этом окисляется, к окислителю, который при этом восстанавливается. Окислителем и восстановителем могут быть как вещества, так и ионы.
Востановитель - это атом, молекула или ион, отдающий электроны, степень окисления элемента при этом повышается.
Окислитель - вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов.
56.Метод ионный баланс
Для подбора коэффициентов в уравнениях окислительно-восстановительных реакций, протекающих в водном растворе при участии ионов, используют метод электронно-ионного баланса.
Метод электронно-ионного баланса складывается из следующих этапов:
а) записывают формулы реагентов данной реакции и устанавливают химическую функцию каждого из них
б) записывают (на следующей строчке) формулы реагентов в ионном виде, указывая только те ионы (для сильных электролитов), молекулы (для слабых электролитов и газов) и формульные единицы (для твердых веществ), которые примут участие в реакции в качестве окислителя, среды и восстановителя
в) определяют восстановленную форму окислителя и окисленную форму восстановителя, что должно быть известно или задано (так, здесь дихромат-ион переходит катионы хрома(III), а сероводород − в серу); эти данные записывают на следующих двух строчках, составляют электронно-ионные уравнения полуреакций восстановления и окисления и подбирают дополнительные множители для уравнений полуреакций
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции, т.е. дополняют запись (б)
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции, т.е. дополняют запись (а), причем формулы катионов и анионов, отсутствующие в ионном уравнении, группируют в формулы дополнительных продуктов
е) проводят проверку подобранных коэффициентов по числу атомов элементов в левой и правой частях уравнения (обычно достаточно только проверить число атомов кислорода)
57. Дисперсные системы
это образования из двух или более числа фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.)
58. Классификация растворов
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
59. Массовая концентрация раствора
Концентрация — величина, характеризующая количественный состав раствора.
В Международной системе единиц (СИ) массовая концентрация вещества в растворе выражается в килограммах на кубический метр (кг/м³). Однако на практике чаще используются величина г/100 мл или г/мл.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы.
ω=m1:m*100%
где:
m1 — масса растворённого вещества, г (кг);
m — общая масса раствора, г (кг).
60. Молярная концентрация раствора
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
М=v:V
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л.
75. Неэлектролиты - Вещества, водные растворы и расплавы которых не проводят электрический ток. Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы.
Электрический ток не проводят газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
К неэлектролитам относят простые вещества (металлы и неметаллы), оксиды, большинство органических веществ: углеводороды, спирты, альдегиды, углеводы, простые и сложные эфиры и др.
74. Сильные электролиты
Это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH)2).
В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
73. Слабые электролиты
Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
К слабым электролитам относятся:
1) почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
4) вода.
Они плохо (или почти не проводят) электрический ток.
СH3COOH «CH3COO- + H+
Cu(OH)2 «[CuOH]+ + OH- (первая ступень)
[CuOH]+ «Cu2+ + OH- (вторая ступень)
H2CO3 «H+ + HCO- (первая ступень)
HCO3- «H+ + CO32- (вторая ступень)
72. Понятие иона:катион,анион
Ио́н- одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения атомом в составе молекулы одного или нескольких электронов. Ионизация (процесс образования ионов) может происходить при высоких температурах, под воздействием электрического поля, ионизирующего излучения и т.п.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 782; Нарушение авторских прав?; Мы поможем в написании вашей работы!