
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правила ориентации
|
|
|
|
1. Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т.е. оказывают ориентирующее действие.
2. По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода.
Ориентанты 1-го рода (орто-пара -ориентанты) направляют последующее замещение преимущественно в орто - и пара -положения.
К ним относятся электронодонорные группы (электронные эффекты групп указаны в скобках):
-R (+I); - OH (+M,-I); - OR (+M,-I); - NH2 (+M,-I); - NR2 (+M,-I)
+M-эффект в этих группах сильнее, чем -I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто - и пара -положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов.
Пример:
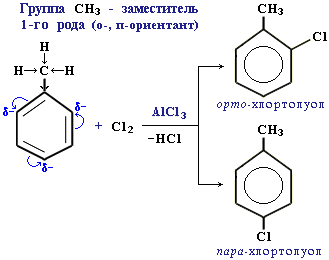
Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.
Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства:- F (+M<–I), - Cl (+M<–I), - Br (+M<–I).
Являясь орто-пара -ориентантами, они замедляют электрофильное замещение. Причина - сильный –I -эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце.
Ориентанты 2-го рода (мета -ориентанты) направляют последующее замещение преимущественно в мета -положение.
К ним относятся электроноакцепторные группы:
- NO2 (–M, –I); - COOH (–M, –I); - CH=O (–M, –I); - SO3H (–I); - NH3+ (–I); - CCl3 (–I).
Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто - и пара -положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета -положении, где электронная плотность несколько выше.
Пример:
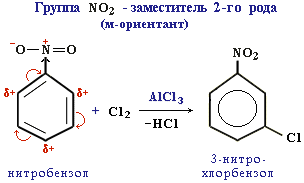
Все ориентанты 2-го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения.
Таким образом, легкость электрофильного замещения для соединений (приведенных в качестве примеров) уменьшается в ряду:
толуол C6H5CH3 > бензол C6H6 > нитробензол C6H5NO2.
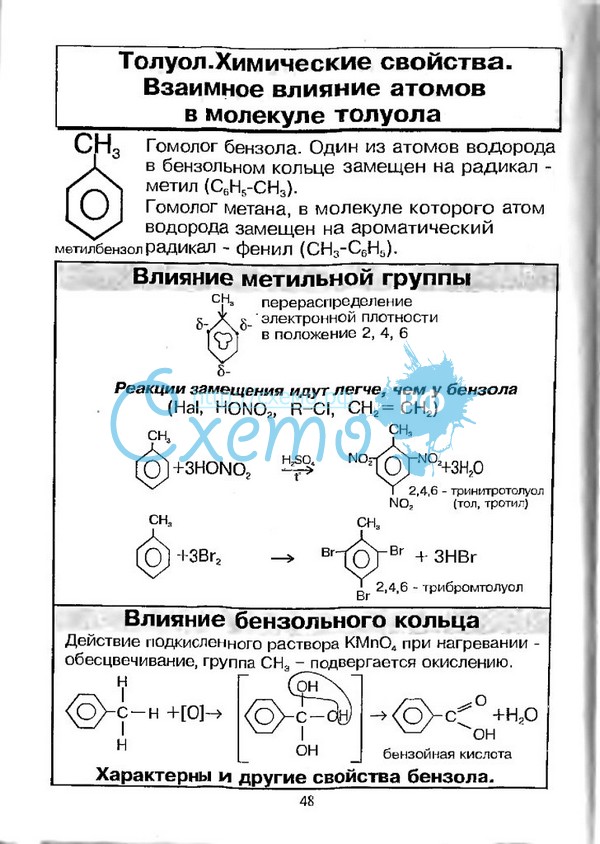
17) 
18) Классификация реагентов и реакций
Вещества, участвующие в реакции, называются реагентом и субстратом.
Когда реакция проходит между органическими и неорганическими соединениями, реагентом называется неорганическое, а субстратом – органическое вещество. В случае реакции между органическими соединениями субстратом называется вещество с более сложной структурой.
Реакционный центр – атом, у которого происходит разрыв или образование связей.
Если в реагенте имеется 2 реакционных центра, он называется амбидентным:
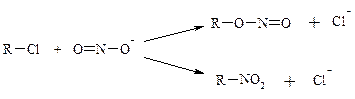
Механизм реакции – это детальное описание пути, ведущего от исходных веществ к продуктам реакции, включающее как можно более полную характеристику состава, строения и других свойств промежуточных соединений и активированных комплексов, а также предположения, касающиеся смещения электронов в ходе последовательных превращений частицы.
I. Классификация реакций по изменениям углеродного скелета
1) Конденсации – реакции, сопровождающиеся увеличением числа атомов углерода за счёт образования новых С–С-связей:

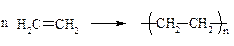 (реакция полимеризации)
(реакция полимеризации)
2) Деградации – реакции, сопровождающиеся уменьшением числа атомов углерода за счёт разрыва С–С-связей:
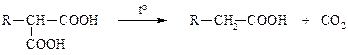
3) Перегруппировки – реакции, в которых число связей С–С остаётся тем же, но изменяется относительное расположение атомов:
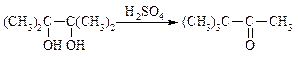
4) Изменение функциональных групп (изменяется природа функциональных групп с сохранением углеродного скелета):
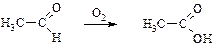
Радикал (буквально: «коренной» от лат. radix — «корень») — термин, используемый в разных отраслях человеческих знаний, каждый раз со своим значением.
нуклеофил в химии (лат. nucleus «ядро», др.-греч. φιλέω «любить») — реагент, образующий химическую связь с партнером по реакции (электрофилом) по донорно-акцепторному механизму, предоставляя электронную пару, образующую новую связь[1]. Вследствие того, что нуклеофилы отдают электроны, они по определению являются основаниями Льюиса. В роли нуклеофилов теоретически могут выступать все ионы и нейтральные молекулы с неподеленной электронной парой
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1891; Нарушение авторских прав?; Мы поможем в написании вашей работы!