
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Температура
|
|
|
|
Для эндотермической реакции (∆Н>0) повышение температуры – благоприятное условие и равновесие смещается в правую сторону.
Для экзотермической реакции благоприятным условием является отвод тепла, по этому понижение температуры приводит к смещению равновесия вправо.
Общий подход к строению и свойствам кристаллических тел дает зонная теория.
Зонная теория базируется на теории молекулярных орбиталей. При образовании кристалла из 2х атомов происходит взаимодействие атомных орбиталей и образование 2х новых молекулярных орбиталей. Одна из них – связывающая, другая – разрыхляющая. Если в образовании кристалла участвуют 4 атома, то 2 связывающих и 2 разрыхляющих.
Т. к. в реальных кристаллах число атомов составляет 1022 – 1023, то количество образующихся молекулярных орбиталей представляет большую величину. В результате расщепления образуется энергетическая зхона, в которой разность между энергетическими уровнями представляет величину 10-28 Дж. В этом случае е легко могут переходить с одного уровня на другой в пределах этой энергетической зоны.
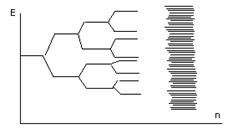
Энергетическая зона охватывает весь кристалл в 3х направлениях. Зоны, образованные внутренними е (не принимающими участие в образовании связи) достаточно узки и не влияют на электропроводность кристалла. А зоны, образованные валентными е, достаточно широки, и они определяют свойства кристаллов.
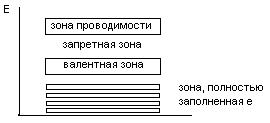
В соответствии с зонной теорией, зона, в которой находятся валентные е, называется валентной зоной.
А зона, имеющая энергию выше, чем валентная зона, и свободная от е, называется зоной проводимости.
Зона между валентной зоной и зоной проводимости – запретная зона.
в основе всех твердых веществ – кристаллическая решетка. Важнейшей характеристикой кристаллической решетки является ее энергия – энергия, необходимая для разрушения кристалла.
Все кристаллические вещества в зависимости от сил, которые связывают отдельные атомы, молекулы, ионы, е делятся на
· молекулярные
· ковалентные
· ионные
· металлические
молекулярные кристаллы. Отдельные молекулы связаны между собой силами Вндер-Вальса (притяжение-отталкивание/силами водородной связи). Энергия кристаллической решетки невелика 10-20 кДж/моль. Непрочные, хрупкие, не проводят электрический ток, обладают низкой теплопроводностью, диэлектрики (H2O, NH3, BF3)
 ковалентные кристаллы. Отдельные атомы связаны между собой химической ковалентной связью.
ковалентные кристаллы. Отдельные атомы связаны между собой химической ковалентной связью.
Энергия кристаллической решетки 200-500 кДж/моль. Высокая температура плавления, прочные, диапазон электропроводности: от типичных диэлектриков до полупроводников (Si, Ge, ZnS, CdS). В таких кристаллах каждый атом отдает в общее пользование 4е для образования связи, по этому связи упорядоченные, в результате прочная кристаллическая структура
Ионные кристаллы. Отдельные ионы связаны электростатическими силами. Ионные кристаллы образуются элементами, которые имеют различную электроотрицательность. Такой кристалл имеет структуру, в которой положительно заряженные частицы окружены частицами, несущими отрицательный заряд, а каждая отрицательная частица окружена частицами с противоположным зарядом (NaCl, BaCl2, KBr). энергия кристаллической решетки 500-800 кДж/моль. Прочные, диэлектрики, растворы таких кристаллов – электролиты.
Металлические кристаллы. к металлам относятся около 80 элементов, которые обладают следующими свойствами:
1) высокая тепло- и электропроводность
2) металлический блеск
3) высокая ковкость
элементы, имеющие небольшое число электронов на внешнем валентном слое (1-3) и большое число вакантных (незаполненных) орбиталей. при кристаллизации атомы упаковываются с максимальной плотностью так, чтобы небольшое число свободных е было доступно для нескольких соседних атомов (8-12) – координационное число
свободные е оказываются не фиксированными у определенного атома и они могут перемещаться внутри кристалла – электродный газ. химическая связь – металлическая. по энергии кристаллической решетки металлы занимают промежуточные состояния между ковалентными и ионными кристаллами
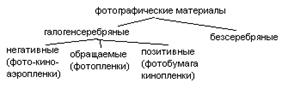
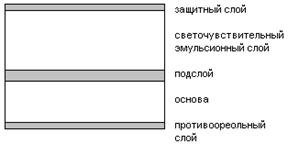
В качестве основы могут быть использованы стеклянные пластинки толщиной 0,8-1 мм. Полимерная пленка из триацетата целлюлозы или полиэтилентерефталата. Толщина таких пленок 50-150 микрон. В качестве основы может быть использована бумага/картон (150-600 микрон). В качестве основы может быть использована ткань, керамика, металл.
Важнейшим слоем является эмульсионный, светочувствительный слой – суспензия микрокристаллов галогенида серебра в природном полимере – желатине (3-25 микрон). В качестве галогенидов серебра используются для малочувствительных пленок AgCl b AgBr, для высокочувствительных – AgBr+AgI.
Чувствительность материала зависит от величины кристаллов галогенида серебра (0,1-2 микрон).
Важную роль в фотоматериале несет желатин, он выполняет несколько функций:
- Является носителем галогенидов серебра, обволакивает кристаллы галогенида серебра – предотвращает их от слипания
- содержит светочувствительные примеси, которые позволяют увеличивать светочувствительность материала
- создает взаимодействие основы с эмульсионным слоем
желатин – природный, белковый материал, который получают при гидролизе кологена.
Противоореольный слой и защитный слои служат для защиты от механических повреждений.
основные стадии фотографического процесса:
1) фотолиз
2) проявление
3) фиксирование и проявка
при фотолизе в фотографическом материале образуется скрытое фотографическое изображение. Центрами такого изображения являются атомы серебра. Механизм образования скрытого фотографического изображения:
кванты света, попадая на кристалл серебра выбивают е (AgBr Br-+hν→Br+e), который попадает в зону проводимости кристалла, движется по кристаллу и находит «ловушку», где взаимодействует с ионом серебра, в результате выделяется атом серебра. В качестве «ловушек» служат примеси в желатин или дефекты кристаллической решетки. В эту же «ловушку» может попасть еще несколько е, в результате выделяется еще несколько атомов серебра
кристалл в дальнейшем может быть проявлен, он будет являться центром светочувствительности, если в нем образовалось минимум 4 атома серебра. Обычно образуется 6-12 атомов серебра.
Большая часть галогенидов серебра не будут являться центрами скрытого изображения – не проявятся.
Чем больше квантов света попадает на кристаллы, тем больше кристаллов будут иметь скрытое изображение.
Стадия проявления – получение видимого фотографического изображения. При этом количество атомов серебра увеличивается в 109 раз.
Проявление – избирательный процесс восстановления галогенида серебра. Восстанавливаются только те кристаллы, которые имеют центр скрытого изображения. Проявление осуществляется в специальных растворах – проявителях. В состав проявителя входят:
1) проявляющее вещество (специально подобрано таким образом, чтобы восстановились только кристаллы, имеющие центр скрытого изображения) – гидрохенон, митол.
2) антиокислитель (предотвращает процесс окисления) – аскорбиновая кислота, сульфат натрия и другие.
3) ускоряющие вещества – щелочи (при увеличении рН среды – скорость возрастает)
4) активирующие вещества
в результате проявления образуется серебряное металлическое изображение. Однако в эмульсионном слое остается большое число галогенидов серебра, не ставших центрами скрытого изображения, по этому эти галогениды серебра надо удалить. На стадии фиксирования галогениды серебра переводят в комплексные соединения, хорошо растворимые в воде, с тем, чтобы в дальнейшем их удалить на стадии промывки. В качестве фиксирующего вещества используется тиосульфат натрия (Na2S2O3)
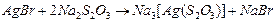
От количества используемого тиосульфата натрия зависит скорость фиксирования (40-50 % vmax).
В цветной фотографии используются 3 эмульсионных светочувствительных слоя – зеленый – синий – красный.
При изготовлении в каждый из этих слоев вносится цветообразующий компонент – бесцветное вещество. Кроме него в каждом эмульсионном слое имеются галогениды серебра (на прядок меньше, чем в черно-белой фотографии)
В цветной фотографии используются другие проявляющие вещества. Во время экспонирования в каждом из 3х эмульсионных слоев образуется скрытое изображение.
Процесс проявления происходит одновременно в 3х эмульсионных слоях, в результате образуются атомы серебра и окисленная форма проявляющего вещества, которое взаимодействует с цветообразующей компонентой – образуется краситель (зеленый, синий, красный).
Процесс отбеливания – удаление атомов серебра (перевод их в растворенную форму)
Фиксирование.
смотри №34
химические вещества
1 мономеры (молекулярная масса до 500 ат. ед.)
2 олигомеры (мол. масса 500-5000 ат. ед.)
3 полимеры (мол. масса больше 5000 ат. ед.)0)а системы.
сти, беспорму термодинамической вероятности называетсяическое состояние называется термодинамической вероятностьюх
полимеры – соединения, состоящие из большого числа повторяющихся звеньев, соединенных в длинные цепи.
Длинна полимера в тысячи раз в тысячи раз больше ширины.
Характерной особенностью полимеров является их цепное строение. Оно придает особые свойства:
1 образование прочных химических связей между отдельными звеньями цепи позволяет полимеры использовать в качестве пленко- и волокнообразующих систем
2 достаточно высокая гибкость отдельных молекул полимера позволяет их использовать в качестве резины и каучуков
3 высокая эластичность полимеров позволяет широко их использовать в виде растворов, что обеспечивает высокую технологичность изготовления различных промышленных изделий
структура полимеров
- линейная
- разветвленная
- сетчатая
разветвленная получается если исходные мономеры имеют несколько функциональных групп
сетчатая получается при сшивке отдельных макромолекул (в частности при вулканизации +S)
структура полимера определяет его свойства
линейные и разветвленные полимеры имеют достаточно большую подвижность относительно простых связей, могут принимать различные конформационные положения, следователдьно они достаточно эластичны и термопластичны, т. е. могут при нагревании переходить в вязко-текучее состояние. А при охлаждении – в стеклообразное. Переходы могут осуществляться многократно, химические свойства полимера не изменятся.
Полимеры, имеющие сетчатую структуру не могут многократно переходить из вязко-текучего состояния в стеклообразное, не могут многократно перерабатываться в промышленности.
Большинство полимеров находится в аморфном состоянии. Однако имеется ряд полимеров, которые могут находится в кристаллическом состоянии (степень кристалличности не больше 80 %).
Полимеры обладают свойством полидисперсности – молекулярная масса отдельных цепей различна. Характерна средняя молекулярная масса.
химические свойства полимеров:
1 линейные и разветвленные полимеры могут образовывать сетчатые структуры. При образовании сетчатых структур возникают боковые функциональные группы полимерных цепей между собой. В некоторых случаях для связывания отдельных цепей вводят специальные вещества – химические модификаторы.
Каучуки, содержащие двойные связи переводятся в сетчатые структуры путем вулканизации.
2 старение полимеров. Под воздействием внешних факторов (температура, кванты света, радиация, действие озона, других химических веществ) происходит разрыв отдельных цепей молекул полимера, в результате молекулярная масса полимера уменьшается и ухудшаются физико-механические свойства. В результате изделие из полимера становится непригодным для эксплуатации.
Для уменьшения процесса старения в процессе изготовления в полимер вводят стабилизаторы (фенолы, ароматические амины)
материалы на основе полимеров (волокна, пенки, лаки, пластмассы, композиты)
волокна получают путем продавливания расплава полимера через тонкие отверстия – фильеры. А затем проводится процесс охлаждения. В качестве волокнообразующих полимеров используют полиакрилоамиды, полиакрилонитрилы
пленки получают путем продавливания расплавов полимеров через фильеры, которые имеют щелевидную форму. Или путем нанесения раствора полимера на движущуюся ленту (полиэтилен, полистирол, полипропилен)
лаки – растворы волокнообразующих полимеров в растворителях. Кроме полимера в лаках содержатся: красители, наполнители, стабилизаторы, отвердители (покраска, нанесение на контакты)
пластмассы. Кроме полимера вводят следующие вещества: красители, наполнители, пластификаторы, стабилизаторы
делятся на
1 термопласты (могут неоднократно переходить из вязко-текучего состояния в стеклообразное. Используются шире, чем реактопласты (полиэтилен, полистирол, полихлорвинил))
2 реактопласты (при получении происходит образование сетчатой структуры полимера. В результате полимер из вязко-текучего состояния переходит в стеклообразное и в дальнейшем не может быть возвращен в исходное состояние (фенолформальдегидные и эпоксидные смолы))
композиты. Основу составляет полимер, в который вводятся армирующие добавки (ткань, металл, керамика). Все композиты обладают повышенной прочностью, в некоторых случаях превышающей прочность металла.
Отдельные представители:
Полиэтилен получают радикальной полимеризацией из этилена. Существует полиэтилен высокого давления (Т=200°С, p=300 атм.) и низкого давления (Т=200°С, р<5 атм.), он обладает лучшими физико-механическими свойствами (- СН2 – СН2 -)
Полиэтилен используют при температуре от 20 до 100°С. Стоек к действию кислот и щелочей, однако набухает в органических растворителях, является хорошим изоляционным материалом, не про пускает влагу, используется для получения пленок в аппаратуростроении
 Полистирол получают радикальной полимеризацией стирола. Стоек к действию кислот, оснований, органических растворителей. Дороже полиэтилена, используется реже (в приборостроении) (-СН – СН -)n
Полистирол получают радикальной полимеризацией стирола. Стоек к действию кислот, оснований, органических растворителей. Дороже полиэтилена, используется реже (в приборостроении) (-СН – СН -)n
Политетрофторэтилен (фторопласт) получают радикальной полимеризацией тетрофторэтилена. Температурный предел от -200 до 250°С. Исключительно стоек к действию концентрированных кислот, щелочей, органических растворителей. Используется как изоляционный материал для химической промышленности (- CF2 – CF2 -)
Каучуки
Общего назначения – получение резины для массового потребления (бутадиеновый каучук, изопропеновый каучук, бутадиенстирольный каучук (- СН – СН2 – СН2 – СН = СН – СН2 -)
Специального назначения – стойкие к действию масел (хлоропреновый каучук), высокопрочные (полиуретановый каучук)
Бутадиен-нитрильный каучук
(- СН2 – С = СН – СН2-)n
|
С ≡ N
методы получения полимеров
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 502; Нарушение авторских прав?; Мы поможем в написании вашей работы!