
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства спиртов
|
|
|
|
Краски
, лакокрасочные материалы, в состав которых входят плёнкообразующие вещества (связующие) и тонкодисперсные неорганические или органические пигменты. Помимо этих основных компонентов, краски могут содержать растворители, наполнители, сиккативы, пластификаторы и др. добавки. Связующими в красках могут служить: растительные масла или олифы; лаки, т. е. растворы природных или синтетических олигомеров или полимеров в органических растворителях; водные дисперсии полимеров; водные растворы растительных или животных клеев, жидкого стекла и др. Применение красок в народном хозяйстве и в быту преследует две основные цели: придание изделиям красивого внешнего вида и защиту поверхности от разрушения под воздействием влаги, солнечной радиации, химических реагентов, высоких температур, плесени и др.
60 см 45. Свободная энергия Гиббса.
1. Альдегиды, спирты и карбоновые кислоты (стр. 468, 471, 450, 464)
Альдегиды - органические соединения, содержащие двухвалентную карбонильную группу (С=О). В альдегидах она связана с одним атомом Н и с углеводородным радикалом (в муравьином альдегиде карбонильная группа связана с 2мя атомами Н).
У альдегидов большая поляризация связи, поэтому они наиболее активны. Кроме того, для альдегидов характерны реакции например гидратация в водном растворе: у метаналя в связи с ещё большей поляризацией связи — полная, а у других альдегидов — частичная:
RC(O)H → RC(OH)2H, где R — Н, любой алкильный или арильный радикал.
Простейшие альдегиды имеют резкий характерный запах (например, бензальдегид — запах миндаля). Под действием гидроксиламина превращаются в оксимы: СН3СНО + NH2OH = CH3C(=NOH)H + H2O
| Название | Формула | Температура плавления | Температура кипения |
| Формальдегид | HCOH | −92 °C | −21 °C |
| Ацетальдегид | CH3COH | −123 °C | 20,8°C |
| Пропаналь | CH3CH2COH | −81 °C | 48,8°C |
| Бутаналь | CH3CH2CH2COH | −97 °C | 75°C |
| Акролеин | CH2=CH-COH | −88 °C | 52,5°C |
| Кротоновый альдегид | CH3-CH=CH-COH | −76,5 °C | 104°C |
| Бензальдегид | C6H5-COH | −56 °C | 179°C |
Химические свойства
Восстановление. Альдегиды способны к восстановлению, основной продукт восстановления — первичные спирты.
Окисление. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты.
Реакция «серебряного зеркала». Альдегид + Ag2O (в аммиачном растворе) = Кислота + 2Ag.
Реакция «медного зеркала». Окислителем здесь выступает Cu(OH)2, гидроксид меди (II)
R—COH + 2Cu(OH)2 → R—COOH + Cu2O + 2H2O
Присоединение синильной кислоты. Используется для удлинения углеродной цепи.
R—COH + HCN → R-CH(OH)-CN
Присоединение гидросульфата натрия. Используется для выделения альдегидов из растворов.
R—COH + NaHSO3 → R-CH(OH)-SO3Na
Проявляют свойства органических оснований.
Биологическое действие
Токсичны. Способны накапливаться в организме. Кроме общетоксичного, обладают раздражающим и нейротоксическим действием. Эффект зависит от молекулярной массы: чем она больше, тем слабее раздражающее, но сильнее наркотическое действие, причём ненасыщенные альдегиды токсичнее насыщенных. Некоторые обладают канцерогенными свойствами. [1]
С другой стороны — входят в состав пищевых продуктов и эссенций (например, ананасовой [2]). Любое вещество, даже самое необходимое, может вызывать токсические эффекты. Действие вещества определяется дозой. В силу сходства химического строения все альдегиды обладают указанными у Лойта свойствами, только чтобы они проявились нужно принять дозу вещества много бо́льшую, чем содержится в пачке миндального печенья. Среднесмертельная дозаароматизатора бензальдегида (для крыс при пероральном введении) составляет 1300 мг на килограмм массы тела (для сравнения: у хлорида натрия среднесмертельная доза — 3000 мг/кг). У «настоящего яда» формальдегида LD50=100 мг/кг.
Спирты - органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным атомом углерода (находящемся в состоянии sp³ гибридизации)[1]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−OH.
Если гидроксильная группа связана с двойной C=C связью, такие соединения называют енолы[2]. Если гидроксильная группа связана напрямую с бензольным кольцом, такие соединения называют фенолы[3].
Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами.
Общие химические методы получения спиртов
Спирты могут быть получены из самых разных классов соединений, таких как углеводороды, алкилгалогениды, амины, карбонильные соединения, эпоксиды. Существует множество методов получения спиртов, среди которых выделим наиболее общие:
реакции окисления — основаны на окислении углеводородов (реже — галогенпроизводных углеводородов), содержащих кратные или активированные C−H связи;
В качестве окислительных агентов для алканов и циклоалканов используются сильные неорганические окислители: озон, перманганат калия, оксид хрома (VI), хромовая кислота, диоксид селена, а также пероксид водорода и некоторые пероксикислоты. Из-за возможности более глубокого окисления, метод имеет значение, как правило, только для получения третичных спиртов[66]:[cтр. 57—59]:

Окисление алкенов значительно более распространено в лабораторной практике, особенно когда речь идёт о получении диолов. В зависимости от выбора реагента можно осуществить син -гидроксилирование (тетраоксид осмия, перманганат калия, хлорат натрия, иод с карбоксилатом серебра и пр.) или анти -гидроксилирование (пероксид водорода и пероксикислоты, оксиды молибдена (VI) и вольфрама (VI), оксид селена (IV) и пр.)[67]:

Алкены также могут гидроксилироваться в аллильное положение синглетным кислородом с миграцией двойной связи и образованием гидропероксидов, которые затем восстанавливаются до спиртов[68]:

Важным препаративным методом является окисление галогенпроизводных углеводородов надпероксидом калия[69].
реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
Для восстановления альдегидов или кетонов, обычно, пользуются борогидридом натрия или калия, а также алюмогидридом лития в протонном растворителе[68]:
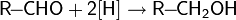
Восстановление сложных эфиров и карбоновых кислот производится алюмогидридом или борогидридом лития, а также некоторыми другими комплексными гидридами[68]:
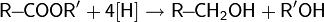
реакции гидратации — кислотно-катализируемое присоединение воды к алкенам (гидратация);

Реакция имеет промышленное значение (например: синтез этанола), однако в лабораторной практике часто замещается реакцией оксимеркурирования-демеркурирования алкенов или гидроборированием алкенов с их последующим окислением[68]:
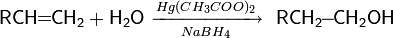
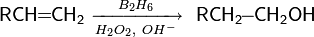
реакции присоединения:
присоединение синтез-газа, формальдегида, оксирана по кратным углеводородным связям;
Простейший пример такой реакции — промышленный синтез метанола[70]:

Среди других вариантов использования:



присоединение нуклеофилов к карбонильным соединениям;
Общая схема реакций подобного типа:

Существует множество реакций присоединения, включая реакции гидратации, этинилирования и прочих, рассмотренных выше. Здесь приведём примеры некоторых важных препаративных методов.
Присоединение аллиборанов с последующим гидролизом[71]:

Реакция Бэйлиса-Хиллмана-Морита[72]:
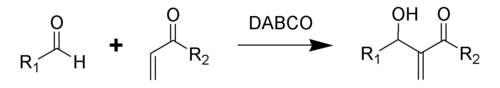
реакции замещения (гидролиза) — реакции нуклеофильного замещения, при которых имеющиеся функциональные группы замещаются на гидроксильную группу;
На практике для реакций замещения, как правило, используются галогенпроизводные:

синтезы с использованием металлорганических соединений.
Использование металлорганических соединений для синтеза спиртов — мощный препаративный метод, позволяющий получить спирты из различных производных.
синтез через реактивы Гриньяра[73]:


реакция Циглера[74]:

синтез с использованием органокупратов[75]:

Физико-химические свойства спиртов определяются в основном строением углеводородной цепи и функциональной группы −OH, а также их взаимным влиянием:
1) Чем больше заместитель, тем сильнее он влияет на функциональную группу, снижая полярность связи O—Н. Реакции, основанные на разрыве этой связи, протекают более медленно.
2) Гидроксильная группа −ОН уменьшает электронную плотность вдоль прилегающих σ-связей углеродной цепи (отрицательный индуктивный эффект).
Все химические реакции спиртов можно разделить на три условных группы, связанных с определёнными реакционными центрами и химическими связями:
Разрыв связи O−H (реакционный центр — водород);
Разрыв или присоединение по связи С−OH (реакционный центр — кислород);
Разрыв связи −СOH (реакционный центр — углерод).
Реакции с участием гидроксильной группы (связи С−O и О−H)
Кислотно-основные реакции спиртов
Со щелочными и щелочноземельными металлами, алюминием, галлием, таллием и некоторыми другими металлами, а также сильными основаниями (например: амидами или гидридами) спирты способны реагировать с образованием алкоголятов[93]:


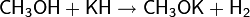
С сильными кислотами Льюиса спирты веду себя подобно основаниям, образуя донорно-акцепторные комплексы[60]:
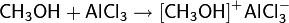
Подробнее о природе кислотно-основных свойствах спиртов смотри раздел: Диссоциация и кислотно-основные свойства спиртов.
Классификация спиртов
Спирты классифицируются следующим образом (в скобках приведены примеры)[5]:
По числу гидроксильных групп:
| — одноатомные спирты (метанол); — двухатомные спирты (этиленгликоль); — трехатомные спирты (глицерин); — четырёхатомные спирты (пентаэритрит); — многоатомные спирты (пятиатомный спирт: ксилит). | 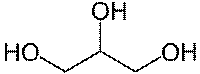
| 
|
| трёхатомный спирт глицерин | четырёхатомный спирт пентаэритрит |
В зависимости от насыщенности углеводородного заместителя:
| — предельные или насыщенные спирты (бутанол); — непредельные или ненасыщенные спирты (аллиловый спирт, пропаргиловый спирт); — ароматические спирты (бензиловый спирт). |
В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
| — алициклические спирты (циклогексанол); — алифатические или ациклические спирты (этанол). |
В зависимости от того, при каком атоме углерода находится гидроксильная группа:
| — первичные спирты (пропанол); — вторичные спирты (изопропиловый спирт); — третичные спирты (2-метилпропан-2-ол). | 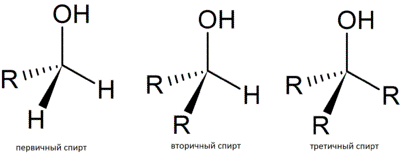
|
Карбоновые кислоты - класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75×10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Кислотными свойствами могут обладать некоторые другие классы органических соединений, например фенолы.
Классификация
В зависимости от радикала, связанного с карбоксилом, различают алифатические (предельные и непредельные), алициклические, ароматические и гетероциклические карбоновые кислоты. По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1108; Нарушение авторских прав?; Мы поможем в написании вашей работы!