
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач 3 страница. а для конечного состояния –
|
|
|
|
p 1 V =(m 1/ M) RT 1, (1)
а для конечного состояния –
p 2 V =(m 2/ M) RT 2, (2)
где m 1 и m 2 — массы гелия в начальном и конечном состояниях.
Выразим массы m 1 и m 2 гелия из уравнений (1) и (2):
m 1= Mp1V /(RT 1); (3)
m2=Mp2V/(RT2); (4)
Вычитая из (3) равенство (4), получим
 .
.
Отсюда найдем искомое давление:
 . (5)
. (5)
Проверим, дает ли правая часть формулы (5) единицу давления. Для этого выразим все величины, входящие в нее, в соответствующих единицах. Единица, в которой выражается первое слагаемое, не вызывает сомнений, так как отношение T 2/ T 1 — величина безразмерная. Проверим, в каких единицах выражается второе слагаемое:
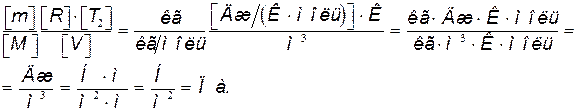
Убедившись в том, что правая часть полученной расчетной формулы дает единицу искомой величины – давления, можем подставить в (5) значения всех величин и произвести вычисления.
В формуле (5) все величины, кроме молярной массы М гелия, известны. Для гелия как одноатомного газа относительная молекулярная масса равна его относительной атомной массе А r.
Из таблицы Д. И. Менделеева найдем А r=4. Следовательно, молярная масса гелия М= А r×10-3 кг/моль =4×10-3 кг/моль. Подставив значения величин в (5), получим
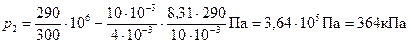 .
.
Пример 7. Определить количество теплоты, поглощаемой водородом массой m =0,2 кг при нагревании его от температуры t 1=0°С до температуры t 2=100 °С при постоянном давлении. Найти также изменение внутренней энергии газа и совершаемую им работу.
Решение. Количество теплоты Q, поглощаемое газом при изобарном нагревании, определяется по формуле
Q=mcpDT, (1)
где m — масса нагреваемого газа; cp — его удельная теплоемкость при постоянном давлении; D T — изменение температуры газа.
Как известно,  . Подставив это выражение c p в формулу (1), получим
. Подставив это выражение c p в формулу (1), получим
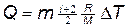 ,
,
где  (молекула водорода двухатомная);
(молекула водорода двухатомная); 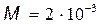 кг/моль – молярная масса водорода.
кг/моль – молярная масса водорода.
Произведя вычисления по этой формуле, найдем
Q =291 кДж.
Внутренняя энергия выражается формулой 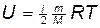 , следовательно, изменение внутренней энергии
, следовательно, изменение внутренней энергии
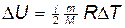 .
.
После подстановки в эту формулу числовых значений величин и вычислений получим DU =208 кДж.
 Работу расширения газа определим по формуле, выражающей первое начало термодинамики: Q=DU+A, откуда
Работу расширения газа определим по формуле, выражающей первое начало термодинамики: Q=DU+A, откуда
A=Q – DU.
Подставив значения Q и DU, найдем
А =83 кДж.
Пример 8. Кислород занимает объем V 1=1 м3 и находится под давлением р 1=200 кПа. Газ нагрели сначала при постоянном давлении до объема V 2=3 м3, a затем при постоянном объеме до давления (рис 20) р 2=500 кПа. Построить график процесса и найти: 1) изменение DU внутренней энергии газа; 2) совершенную им работу A; 3) количество теплоты Q,переданное газу.
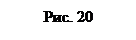 Решение. Построим график процесса (рис. 20). На графике точками 1, 2, 3 обозначены состояния газа, характеризуемые параметрами (р 1, V 1, T 1), (р 1, V 2, T 2),(р 2, V 2, T 3).
Решение. Построим график процесса (рис. 20). На графике точками 1, 2, 3 обозначены состояния газа, характеризуемые параметрами (р 1, V 1, T 1), (р 1, V 2, T 2),(р 2, V 2, T 3).
1. Изменение внутренней энергии газа при переходе его из состояния 1 в состояние 3 выражается формулой
DU=cvmDT,
где c v — удельная теплоемкость газа при постоянном объеме; m — масса газа; D T — разность температур, соответствующих конечному 3и начальному 1 состояниям, т. е. D T = T 3 – T 1. Так как  ;
;
где М — молярная масса газа, то
 . (1)
. (1)
Температуры T 1 и T 3 выразим из уравнения Менделеева — Клапейрона ( ):
):

С учетом этого равенство (1) перепишем в виде
DU=(i/2)(p2V2 – p1V1).
Подставим сюда значения величин (учтем, что для кислорода, как двухатомного газа, i =5) и произведем вычисления:
DU=3,25 МДж.
2. Полная работа, совершаемая газом, равна A = A 1+ A 2, где A 1 — работа на участке 1—2; A 2 — работа на участке 2—3,
На участке 1—2 давление постоянно (p =const). Работа в этом случае выражается формулой A 1= p 1D V = p 1(V 2 – V 1). На участке 2—3 объем газа не изменяется и, следовательно, работа газа на этом участке равна нулю (A 2=0). Таким образом,
A=A1=p1(V2—V1).
Подставив в эту формулу значения физических величин, произведем вычисления:
A=0,4 МДж
 3. Согласно первому началу термодинамики, количество теплоты Q, переданное газу, равно сумме работы A, совершенной газом, и изменению D U внутренней энергии:
3. Согласно первому началу термодинамики, количество теплоты Q, переданное газу, равно сумме работы A, совершенной газом, и изменению D U внутренней энергии:
Q=A+DU, или Q =3,65 МДж.
Пример 9. Идеальный двухатомный газ, содержащий количество вещества 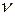 =l моль, находится под давлением p 1=250кПа и занимает объем V 1==10 л. Сначала газ изохорно нагревают до температуры T 2=400 К. Далее, изотермически расширяя, доводят его до первоначального давления. После этого путем изобарного сжатия возвращают газ в начальное состояние. Определить термический КПД h цикла.
=l моль, находится под давлением p 1=250кПа и занимает объем V 1==10 л. Сначала газ изохорно нагревают до температуры T 2=400 К. Далее, изотермически расширяя, доводят его до первоначального давления. После этого путем изобарного сжатия возвращают газ в начальное состояние. Определить термический КПД h цикла.
Решение. Для наглядности построим сначала график цикла, который состоит из изохоры, изотермы и изобары. В координатах р, V этот цикл имеет вид. представленный на рис. 21. Характерные точки цикла обозначим 1, 2, 3.
Термический КПД любого цикла определяется выражением
h=(Q1 – Q2)/Q1, или h =1 – Q2/Q1, (1)
 где Q 1 — количество теплоты, полученное газом за цикл от нагревателя; Q 2 — количество теплоты, отданное газом за цикл охладителю.
где Q 1 — количество теплоты, полученное газом за цикл от нагревателя; Q 2 — количество теплоты, отданное газом за цикл охладителю.
Заметим, что разность количеств теплоты Q 1 – Q 2 равна работе A, совершаемой газом за цикл. Эта работа на графике в координатах р, V (рис. 21) изображается площадью цикла (площадь цикла заштрихована).
Рабочее вещество (газ) получает количество теплоты Q 1 на двух участках: Q 1-2 на участке 1—2 (изохорный процесс) и Q 2-3 на участке 2—3 (изотермический процесс). Таким образом,
Q1=Q1-2+Q2-3.
Количество теплоты, полученное газом при изохорном процессе, равно
Q1-2= C v 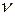 (T 2 – T 1),
(T 2 – T 1),
где C v — молярная теплоемкость газа при постоянном объеме; 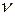 — количество вещества. Температуру T 1 начального состояния газа найдем, воспользовавшись уравнением Клапейрона — Менделеева:
— количество вещества. Температуру T 1 начального состояния газа найдем, воспользовавшись уравнением Клапейрона — Менделеева:
T1=p1V1/(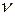 R).
R).
Подставив числовые значения и произведя вычисления, получим
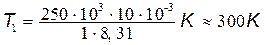 .
.
Количество теплоты, полученное газом при изотермическом процессе, равно
Q 2-3= 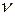 RT 2ln(V 2/ V 1),
RT 2ln(V 2/ V 1),
где V 2 — объем, занимаемый газом при температуре T 2 и давлении p 1 (точка 3 на графике).
На участке 3—1 газ отдает количество теплоты Q 2, равное
Q 2= Q 3-1= Cp 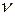 (T 2 – T 1),
(T 2 – T 1),
где Cp — молярная теплоемкость газа при изобарном процессе.
Подставим найденные значения Q 1 и Q 2 в формулу (1):
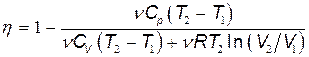
В полученном выражении заменим отношение объемов V 2/ V 1, согласно закону Гей-Люссака, отношением температур (V 2/ V 1= T 2/ T 1) и зная C v и Cp для двухатомного газа [ C v=5 R /2, C p =7 R /2]. Тогда после сокращения на 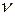 и R /2получим
и R /2получим
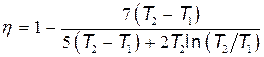 .
.
Подставив значения T 1, T 2 и R и произведя вычисления, найдем
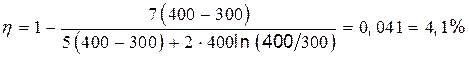 .
.
Пример 10. В цилиндре под поршнем находится водород массой m =0,02 кг при температуре T 1=300K. Водород начал расширяться адиабатно, увеличив свой объем в пять раз, а затем был сжат изотермически, причем объем газа уменьшился в пять раз. Найти температуру Т 2, в конце адиабатного расширения и работу А, совершенную газом. Изобразить процесс графически.
Решение. Температуры и объемы газа, совершающего адиабатный процесс, связаны между собой соотношением
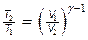 ,
,
где g — показатель адиабаты (для водорода как двухатомного газа g =1,4).
Отсюда получаем выражение для конечной температуры T 2:
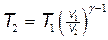 .
.
Подставляя числовые значения заданных величин, находим
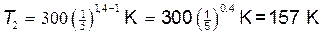 .
.
Работа A 1 газа при адиабатном расширении определяется по формуле
 .
.
Подставив сюда числовые значения величин, после вычисления получим
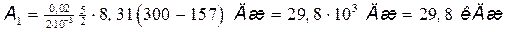 .
.
Работа A 2 газа при изотермическом сжатии выражается формулой
 A2=RT2(m/M)ln(V1/V2).
A2=RT2(m/M)ln(V1/V2).
Произведя вычисления по этой формуле, найдем
A 2= – 21 кДж.
Знак минус показывает, что при сжатии газа работа совершена внешними силами.
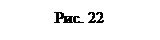 Общая работа, совершенная газом при рассмотренных процессах, А = A 1+ A 2=29,8кДж + (–21 кДж) =8,8 кДж.
Общая работа, совершенная газом при рассмотренных процессах, А = A 1+ A 2=29,8кДж + (–21 кДж) =8,8 кДж.
График процесса приведен на рис. 22.
Пример 11. Нагреватель тепловой машины, работающей по обратимому циклу Карно, имеет температуру t 1=200°С. Определить температуру Т 2, охладителя, если при получении от нагревателя количества теплоты Q 1= 1 Дж машина совершает работу A=0,4 Дж? Потери на трение и теплоотдачу не учитывать.
Решение. Температуру охладителя найдем, использовав выражение для термического КПД машины, работающей по циклу Карно, h =(T 1 – T 2)/ T 1. Отсюда
T 2 = T 1(1 – h). (1)
Термический КПД тепловой машины выражает отношение количества теплоты, которое превращено в механическую работу A, к количеству теплоты Q 1, которое получено рабочим телом тепловой машины из внешней среды (от нагревателя), т. е. h = A/Q 1. Подставив это выражение в формулу (1), найдем
T 2= T 1(1 – A/Q). (2)
Учтя, что T 1=473 К, после вычисления по формуле (2) получим T 2=284 К.
Пример 12. Найти изменение D S энтропии при нагревании воды массой m =100 г от температуры t 1=0°C до температуры t 2=100 °С и последующем превращении воды в пар той же температуры.
Решение. Найдем отдельно изменение энтропии D S ' при нагревании воды и изменение энтропии D S " при превращении ее в пар. Полное изменение энтропии выразится суммой D S ' и D S ".
Как известно, изменение энтропии выражается общей формулой
 (1)
(1)
При бесконечно малом изменении dT температуры нагреваемого тела затрачивается количество теплоты 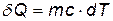 , где m — масса тела; с — его удельная теплоемкость. Подставив выражение
, где m — масса тела; с — его удельная теплоемкость. Подставив выражение 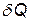 в равенство (1), найдем формулу для вычисления изменения энтропии при нагревании воды:
в равенство (1), найдем формулу для вычисления изменения энтропии при нагревании воды:
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 844; Нарушение авторских прав?; Мы поможем в написании вашей работы!