
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальвани-потенциал и вольта-потенциал
|
|
|
|
Поверхностный потенциал
Составляющие внутреннего потенциала
¨ Внутренний электростатический потенциал фазы φα представляет собой сумму внешнего ψα и поверхностного χα потенциалов:
φα = ψα + χα
¨ Внешний потенциал равен изменению потенциала при переносе отрицательного заряда из вакуума к поверхности фазы.
¨ Внешний потенциал обусловлен взаимодействием заряда со свободными зарядами в фазе.
¨ Поверхностный потенциал (χα) равен изменению потенциала при переносе заряда через границу поверхность среды
¨ Если свободный электростатический заряд равен нулю, то ψα = 0 и, следовательно, φα = χα
¨ Для растворов χα появляется вследствие ориентации диполей молекул растворителя на поверхности.
¨ На границе металл-вакуум χα обусловлен возникновением дипольного момента вследствие частичного смещения электронной плотности относительно ионов кристаллической решетки металла
¨ Разность внутренних потенциалов двух фаз называют гальвани-потенциалом
¨ 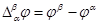
¨ Величину гальвани-потенциала невозможно определить в эксперименте
¨ Разность внешних потенциалов двух фаз называют вольта-потенциалом
¨ 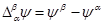
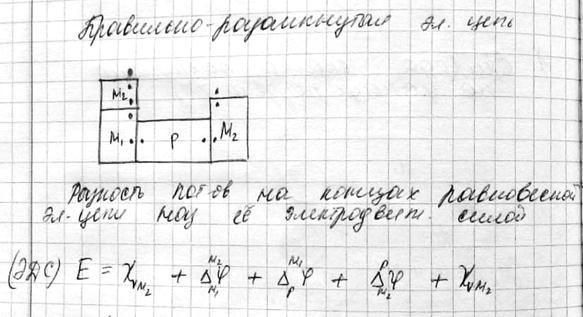
Гальванипотенциал нельзя измерить экспериментально, вольта – можно. ЭДС правильно разомкнутой цепи можно представить как минимум 3-мя гальванипотенциалами.
4) Равновесие в электрохимической цепи, электродный потенциал.
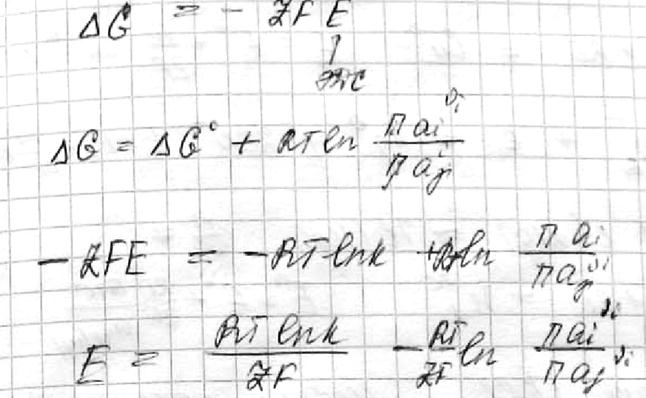
¨ Участники электрохимических процессов разделены в пространстве, поэтому общий процесс можно разделить на две полуреакции.
¨ Соответственно, э.д.с. системы можно представить в виде суммы двух электродных потенциалов:
E = φ1 + φ2
E º = φº1 + φº2
¨ Для полуреакции на каждом электроде можно записать уравнение Нернста
¨ В общем случае можно определить только сумму электродных потенциалов, но не их абсолютное значение.

5) ЭДС равновесной электрохимической цепи, правильноразомкнутая электрохимическая цепь, закон вольта. Потенциал нулевого заряда

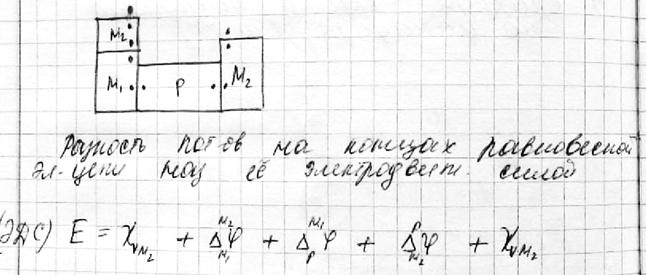
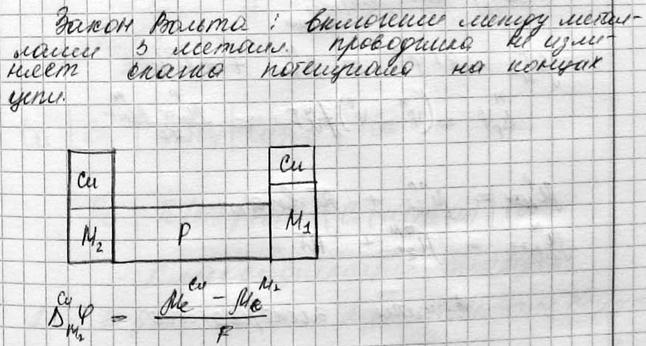

ПОТЕНЦИАЛ НУЛЕВОГО ЗАРЯДА (ПНЗ), потенциал электрода, заряд пов-сти к-рого Q равен нулю. При этом величина Q определяется как кол-во электричества, к-рое необходимо сообщить электроду при увеличении площади его пов-сти на единицу для того, чтобы потенциал электрода Е оставался постоянным.
6) Окислительно-восстановительные полуреакции, электродный потенциал, стандартный электродный потенциал, правила записи электродов




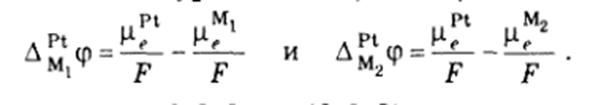
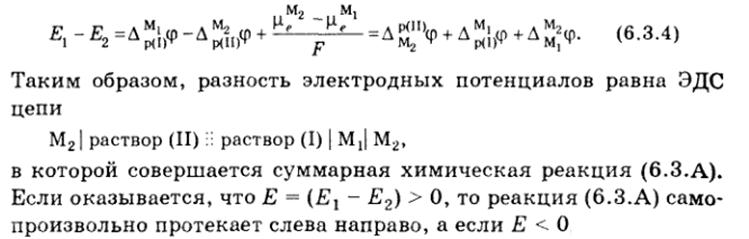

¨ Правила записи электродов
¨ В электродной полуреакции слева записывают окисленную форму, а справа – восстановленную.
¨ Вертикальная линия (|) обозначает границу раздела фаз, двойная вертикальная линия (||) – границу между растворами с устраненным диффузионным потенциалом, прерывистая вертикальная линия () – границу между растворами с диффузионным потенциалом.
¨ В электрохимической цепи левый электрод включается в обратном направлении, а правый – в прямом.
¨ Э.д.с. цепи равна
E = E п – E л
7) Классификация электродов: первого, второго, третьего рода, сравнения: водородный, хлорсеребряный, каломельный. Окислительно-восстановительные и газовые
Классификация электродов
¨ Электроды первого рода
¤ Металлические
¤ Газовые
¤ Амальгамные
¨ Электроды второго рода
¨ Электроды третьего рода
¨ Окислительно-восстановительные электроды
¨ Ион-селективные электроды
¤ Стеклянные электроды
¤ Электроды с полимерными мембранами
¤ Ферментные электроды и т.д.
Электроды первого рода
Электроды первого рода – системы, у которых значение электродных потенциалов зависит от активности окисленной (или восстановленной) формы, обратимые относительно катиона или аниона
Металлические электроды
Zn2+ + 2e − = Zn Zn2+|Zn 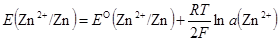
Газовые электроды
H+(р-р) + e − = ½ H2(г) H+|H2|Pt 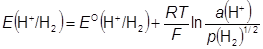
¨ Электроды первого рода
¤ Газовые электроды
½ Cl2(г) + e − = Cl − Cl − |Cl2|Pt 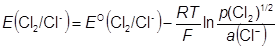
¤ Амальгамные электроды
Tl+ + e − = Tl(Hg) Tl+|Tl(Hg)|Pt 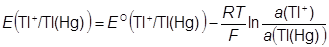
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 5808; Нарушение авторских прав?; Мы поможем в написании вашей работы!