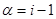КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
I. Закон и изотонический коэффициент Вант-Гоффа
|
|
|
|
Расчетные формулы

Где:
Þ  – концентрация растворенного вещества;
– концентрация растворенного вещества;
Þ Т – температура раствора 0оС (273 К);
Þ R – универсальная газовая постоянная, не зависящая от природы газа. В системе СИ R=8,314103 Дж/(кмольК) или R=8,314Дж/(мольК).
Следовательно, осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы при данной температуре оно в виде газа занимало объём раствора ( осмотический закон Вант- Гоффа).
Пример: 1 М раствор 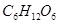 . Определите
. Определите 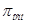 .
.
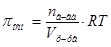
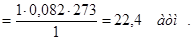 или
или 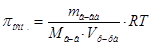 .
.
Примечание: Чем  , тем
, тем  (например, белки).
(например, белки).
Изотонический коэффициент (i) Вант-Гоффа. Степень диссоциации  и связь между
и связь между  и
и 
Изотонический коэффициент показывает, во сколько раз возрастает концентрация ионов за счет диссоциации электролита. В растворах электролитов вследствие электролитической диссоциации и увеличения числа частиц опытное осмотическое давление всегда больше, чем теоретически вычисленное по уравнению: 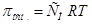 . Степень отклонения наблюдаемого осмотического давления
. Степень отклонения наблюдаемого осмотического давления 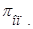 от теоретически вычисленной величины
от теоретически вычисленной величины 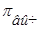 выражается изотоническим коэффициентом (i) т.е.
выражается изотоническим коэффициентом (i) т.е.  . Поэтому при вычислении осмотического давления растворов электролитов в уравнение вводят поправочный (изотонический) коэффициент:
. Поэтому при вычислении осмотического давления растворов электролитов в уравнение вводят поправочный (изотонический) коэффициент: 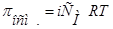
|
Ассоциация молекул вещества – причина понижения значений коллигативных свойств по сравнению с вычисленными значениями (например, As2S3).

Значение его увеличивается по мере разбавления электролита, приближаясь к определенному пределу для каждого отдельного электролита.
|
Если при диссоциации молекулы образуется два иона: 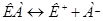 , то К=2 и формула примет простой вид:
, то К=2 и формула примет простой вид:
|
При вычислении степени диссоциации сильных электролитов говорят не об истинной, а о «кажущейся» степени диссоциации вещества в растворе, т.к. при опытном определении степень диссоциации сильных электролитов всегда оказывается меньше 100%. Это объясняется проявлением электростатического притяжения между ионами, вследствие чего активность их уменьшается и создается видимость неполной диссоциации.

Осмолярная и осмоляльная концентрация  в практической медицине
в практической медицине
Осмолярная концентрация раствора х арактеризует содержание подвижных частиц в миллиосмолях в 1 л раствора / 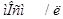 /, а осмоляльная концентрация – в 1 кг растворителя /
/, а осмоляльная концентрация – в 1 кг растворителя /  /. Биологические среды (сыворотка крови и моча) – это относительно разбавленные системы, поэтому разница между осмолярностью и осмоляльностью незначительная, т.е. эти термины взаимозаменяемые. Определяется криометрией.
/. Биологические среды (сыворотка крови и моча) – это относительно разбавленные системы, поэтому разница между осмолярностью и осмоляльностью незначительная, т.е. эти термины взаимозаменяемые. Определяется криометрией.
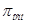 внутри и вне клетки одинаково, т.е. осмоляльность внутриклеточной жидкости равна осмоляльности плазмы крови.
внутри и вне клетки одинаково, т.е. осмоляльность внутриклеточной жидкости равна осмоляльности плазмы крови. 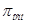 крови человека соответствует осмолярная концентрация частиц от 290 до 300
крови человека соответствует осмолярная концентрация частиц от 290 до 300 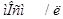 . Такое состояние – изоосмия.
. Такое состояние – изоосмия.
Осмолярная концентрация с вязана с его молярной концентрацией через изотонический коэффициент:

|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 2827; Нарушение авторских прав?; Мы поможем в написании вашей работы!

 или
или
 или
или