
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Криоскопическим методом
|
|
|
|
Экспериментальная часть
Лабораторная работа. Определение молярной массы неэлектролита
Принцип метода. В основе криоскопического метода определения молекулярной массы вещества лежит закон Рауля, причем он справедлив для сильно разбавленных растворов неэлектролитов. При затвердевании такого раствора сначала выпадают кристаллы чистого растворителя, и раствор становится более концентрированным, а температура кристаллизации – наиболее низкой. Поэтому при определении температуры затвердевания раствора следует измерять температуру начала кристаллизации. При этом нельзя допускать сильного переохлаждения раствора (более чем на 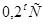 ).
).
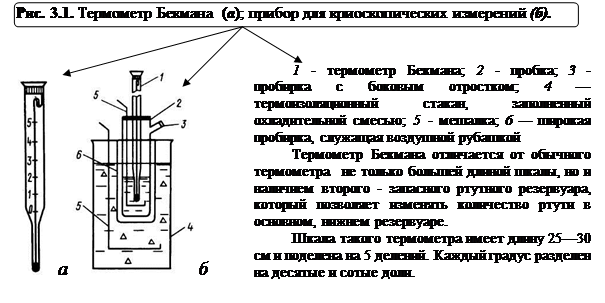
Криоскопический метод является более точным, чем эбуллиоскопический, так как в этом случае не происходит потери растворителя путем испарения, криоскопическая постоянная воды больше эбуллиоскопической, что повышает точность отсчетов при определении ∆  . В криоскопическом методе точность определения молекулярной массы зависит от точности измерения температуры. Для этого пользуются специальным термометром Бекмана (см. рисунок 3.1(а)), предназначенным для измерения малых разностей температур.
. В криоскопическом методе точность определения молекулярной массы зависит от точности измерения температуры. Для этого пользуются специальным термометром Бекмана (см. рисунок 3.1(а)), предназначенным для измерения малых разностей температур.
Цель работы. Научиться методом криоскопии определять молярную массу растворенного вещества.
Приборы и оборудование: криометр, дифференциальный термометр Бекмена, термометр химический.
Реактивы: лед колотый или снег, хлорид натрия (крист.), навеска исследуемого вещества (сахароза С12Н22О11); вода дистиллированная.
Ход работы:
1. Заполните внешний сосуд криометра (см. рисунок 3.1), т.е. стакан / 4/ охладительной смесью из воды, льда и технической соли 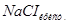 (40-50 г) с температурой на 3–4о ниже 0оС, закройте его крышкой со вставленной в нее мешалкой /5/ и сосудом / 3/.
(40-50 г) с температурой на 3–4о ниже 0оС, закройте его крышкой со вставленной в нее мешалкой /5/ и сосудом / 3/.
2. Отмерьте из бюретки в сосуд / 3/, или взвесьте на аналитических весах, ≈ 20,00 см3 растворителя / 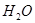 /.
/.
3. Настройте термометр Бекмана / 1 / и вставьте в прибор в вертикальном положении, он не должен касаться стенок сосуда. После настройки данный термометр нельзя класть горизонтально и встряхивать, чтобы из капилляра в верхний резервуар не упала капелька ртути.
4. Медленно помешивайте жидкость до температуры на 0,5оС выше ожидаемой температуры кристаллизации, затем, прекратив помешивание, наблюдайте за понижением температуры (для чистого растворителя до –0,5- –1,0оС).
5. Возобновите перемешивание переохлажденной жидкости, что вызовет кристаллизацию и повышение температуры. Не прекращая перемешивания, отмечайте максимальную температуру подъема (из переохлажденного состояния), которая и будет истинной температурой кристаллизации данной жидкости.
6. Выньте сосуд / 3/ из стакана / 4/ и, подогревая его рукой, растворите образовавшиеся кристаллы.
7. Опустите сосуд / 3/ снова в стакан / 4/ и повторите переохлаждение с последующей кристаллизацией. Опыт повторите несколько раз, пока последние два определения температуры кристаллизации будут отличаться не более чем на 0,01оС.
8. Определив температуру кристаллизации растворителя, через боковой тубус сосуда / 3/, всыпьте навеску исследуемого вещества и, вынув сосуд с веществом и растворителем, подогрейте его рукой, вызывая расплавление кристаллов растворителя и растворение в нем навески.
9. Вставив сосуд в стакан /4/, проведите процесс охлаждения так же, как это предписано выше в пп. 3-5. (Раствор переохлаждать более чем на 0,2 оС нельзя).
10. Все вышеуказанные данные и результаты опыта внесите в таблицу № 3.1.
11. Отчет о работе состоит из непосредственной записи наблюдений и вычислений по ниже указанной форме.
а) Температуру кристаллизации раствора определите 3–4 раза; из полученных данных рассчитайте среднюю температуру кристаллизации /  / и разность средних температур кристаллизации растворителя, раствора
/ и разность средних температур кристаллизации растворителя, раствора  по формуле:
по формуле: 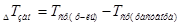 .
.
б) Рассчитайте молярную массу растворенного вещества по формуле: 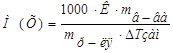 ,
,
где 
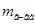 – масса растворенного вещества, г;
– масса растворенного вещества, г;  - масса растворителя (воды, г).
- масса растворителя (воды, г).
Таблица №3.1
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 1880; Нарушение авторских прав?; Мы поможем в написании вашей работы!