
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Практическая часть. 1.1.Ситуационные задачи (№№ с 1-по 8)с алгоритмами их решений, эталонами ответов и с комментариями
|
|
|
|
1.1.Ситуационные задачи (№№ с 1-по 8) с алгоритмами их решений, эталонами ответов и с комментариями
Вычисление степени и константы электролитической диссоциации
Задача 1. Чему равна степень электролитической диссоциации уксусной кислоты в водном растворе с  = 0,01 моль/л? Константа диссоциации уксусной кислоты
= 0,01 моль/л? Константа диссоциации уксусной кислоты  .
.
Решение.
1. Запишем уравнение диссоциации уксусной кислоты в водном растворе и константу электролитической диссоциации:


Как видно, из задачи, концентрации всех частиц, образующихся при диссоциации, могут быть определены через исходную концентрацию вещества / с/ и степень электролитической диссоциации /  /:
/:
 |


2. Выражение константы диссоциации примет вид:  . Так как электролит слабый (<<1), то выражение упрощается:
. Так как электролит слабый (<<1), то выражение упрощается:  или
или 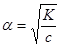 .
.
3. Подставляя данные, получим:  или 4,5%.
или 4,5%.
Ответ. 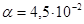 или 4,5%.
или 4,5%.
Вычисление ионной силы и коэффициента активности ионов
Задача 2. Вычислите ионную силу раствора, содержащего в 1 л 0,005 моль нитрата меди 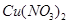 и 0,001 моль сульфата алюминия
и 0,001 моль сульфата алюминия  .
.
Эталон решение.
1. Зная, что 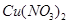
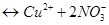 и
и 
 , ионную силу раствора вычисляем по формуле, предложенной Г.Н. Льюисом и М. Ренделом (1921 г):
, ионную силу раствора вычисляем по формуле, предложенной Г.Н. Льюисом и М. Ренделом (1921 г):  . Таким образом,
. Таким образом, 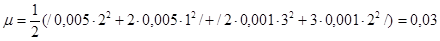 .
.
Ответ. 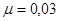
Вычисление концентрации ионов H+ и OH-
Задача 3. При добавлении к воде раствора гидроксида калия /КОН/ концентрация гидроксид- ионов стала равной 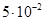 моль/л. Вычислите молярную концентрацию ионов водорода
моль/л. Вычислите молярную концентрацию ионов водорода 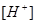 , если температура раствора 40оС.
, если температура раствора 40оС.
Решение.
1. По таблице 5.1. находим величину 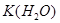 при 40оС, отсюда
при 40оС, отсюда 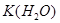 =
=  . Обратить внимание!!! Если в задаче не указана температура, то ее принимают равной 25оС, а при этом
. Обратить внимание!!! Если в задаче не указана температура, то ее принимают равной 25оС, а при этом 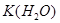 =
=  .
.
2. Вычислим концентрацию ионов 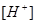 :
:
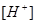 =
=  =
=  , или
, или 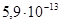 моль/л.
моль/л.
Ответ. 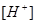 =
= 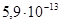 моль/л.
моль/л.
Задача 4. Во сколько раз увеличится активность и концентрация ионов H+ при нагревании воды от 18 до 80оС?
Решение.
1. По таблице №5.1. находим величины константы ионного произведения при 18 и 80оС: 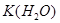 (при 18оС)=
(при 18оС)=  ,
, 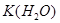 (при 18оС)=
(при 18оС)=  .
.
2. 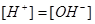 при 18оС =
при 18оС = 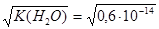
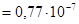 моль/л.
моль/л.
3. 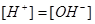 при 80оС =
при 80оС = 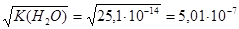 моль/л.
моль/л.
4. Сопоставляя концентрации ионов Н+ и ОН- при 18оС с концентрациями при 80оС, находим на сколько раз увеличится активность и концентрация ионов Н+:  раз.
раз.
Ответ. При повышении температуры активность и концентрация ионов Н+увеличивается 6.5 раз.
Вычисление рН растворов по известной концентрации H+- ионов
Задача 5. В биохимическом анализе используется 0,001 моль/л раствор HCl Определите рН этого раствора.
Решение.
1. Сильные электролиты в водных растворах дислоцируют полностью:  , поэтому.
, поэтому.  .
.
2. По концентрации ионов 
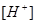 находим рН раствора:
находим рН раствора: 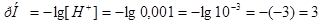 .
.
Ответ. 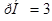 . Значение рН
. Значение рН  1 указывает на то, что в клиническом анализе используется слабая кислота.
1 указывает на то, что в клиническом анализе используется слабая кислота.
Вычисление молярной концентрации ионов водорода [H+] по известной их рН
Задача 6. Вычислить [H+] в ротовой жидкости, если рН=8,3.
Решение.
1. Рассчитаем 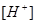 для ротовой жидкости:
для ротовой жидкости: 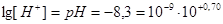 .
.
2. По таблице антилогарифмов находим значение: 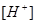 =
=  [9-0,700]=
[9-0,700]=  моль/л.
моль/л.
Ответ. 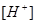 =
=  моль/л.
моль/л.
Вычисление рН растворов сильных и слабых электролитов по известной их молярной концентрации
Задача №7. Определите рН раствора 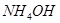 , в котором
, в котором 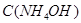 =0,1 моль/л (
=0,1 моль/л ( ).
).
Эталон решение.
1. Гидроксида аммония считается слабым электролитом, поэтому для неё применим закон Оствальда: 
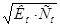 =
=  =
=  моль/л.
моль/л.
2. Далее возможны два пути решения: а) через ионное произведение воды, или через показатель ионного произведения воды / 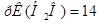 /.
/.
а) 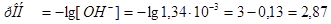 .
.
б) 
Ответ.  .
.
Вычисление константы и степени гидролиза солей
Задача 8. Вычислите константу и степень гидролиза 0,1 М раствора no первой ступени.
Эталон решение.
1. Первая ступень гидролиза 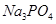 выражается уравнением:
выражается уравнением:
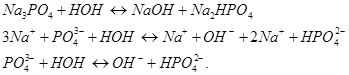
2.  Из уравнения закона действия масс выведем уравнение константы химического равновесия:
Из уравнения закона действия масс выведем уравнение константы химического равновесия:  , а из него выведем константу гидролиза:
, а из него выведем константу гидролиза: 
3. Из ионного произведения воды находим, что:  .
.
4. Подставив выражение для  в уравнение константы гидролиза и зная, что:
в уравнение константы гидролиза и зная, что:  находим:
находим: 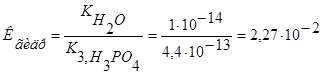 .
.
5. Для вычисления степени гидролиза воспользуемся формулой:  Поскольку величина
Поскольку величина  большая, то вычисления будем вести по полной формуле:
большая, то вычисления будем вести по полной формуле: 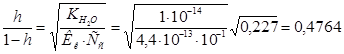
6. Следовательно, 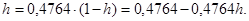 Таким образом,
Таким образом,  или 32,26%.
или 32,26%.
Ответ. 
1.2. Ситуационные задачи (№№ с 9 по 19) для закрепления материала (выполнить в протокольной тетради).
Задача №9. Вычислите степень и константу ионизации муравьиной кислоты, если концентрация ионов водорода в 0,2 М растворе муравьиной кислоты равна 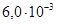 моль/л.
моль/л.
Задача №10. Для устранения условного рефлекса на алкоголь назначают 1% (ρ= 1 г/мл) раствор сульфата меди. Вычислите активность ионов меди в таком растворе (Т=298 К) и определите, сколько мг 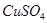 содержится в шприце объемом 1 мл.
содержится в шприце объемом 1 мл.
Задача №11. Каковы ионная сила и активность ацетилсалициловой кислоты (аспирина) в растворе концентрации 0,01 моль/л, если константа диссоциации равна 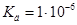 ?
?
Задача №12.. Вычислите концентрацию ионов водорода и гидроксида для следующих растворов: а) мочи (рН=6,0) б) ротовой жидкости (рН=6,39); в) крови (рН=7,34) г) желудочного сока (рН=0,9).
Задача №13. Вычислите концентрацию ионов  и величину
и величину 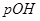 , если в центре долек клетка печени
, если в центре долек клетка печени 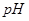 = 6,8.
= 6,8.
Задача №14. Определить концентрации 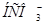 и
и  в 0,01 М растворе угольной кислоты, если рН этого раствора равен 4,18.
в 0,01 М растворе угольной кислоты, если рН этого раствора равен 4,18.
Задача №15. При отравлении 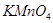 , который является сильным окислителем, используют восстановитель -
, который является сильным окислителем, используют восстановитель - 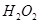 .Однако в препарате
.Однако в препарате 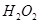 возможна избыточная кислотность, вызванная либо способом получения ее, либо добавлением в качестве консерванта кислот, поэтому ГФ устанавливает предел кислотности. Рассчитайте значение рН 3,0%-го водного раствора Н2О2. Плотность раствора принять равной 1 г/см3. Константа кислотной диссоциации пероксида водорода
возможна избыточная кислотность, вызванная либо способом получения ее, либо добавлением в качестве консерванта кислот, поэтому ГФ устанавливает предел кислотности. Рассчитайте значение рН 3,0%-го водного раствора Н2О2. Плотность раствора принять равной 1 г/см3. Константа кислотной диссоциации пероксида водорода 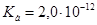 ,
, 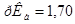 .
.
Задача №16. Для корреляции кислотно-щелочного равновесия при алкалозе используют 5% раствор аскорбиновой кислоты (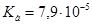 ;
; 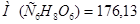 г/моль;
г/моль; 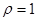 г/см3). Определите рН данного раствора.
г/см3). Определите рН данного раствора.
Задача №17. Определите рН раствора 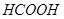 , в котором
, в котором  =0,1 моль/л (
=0,1 моль/л (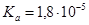 ) и раствора
) и раствора 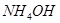 , в котором
, в котором 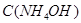 =0,2 моль/л (
=0,2 моль/л ( ).
).
Задача №18. Определите, как изменится рН водного раствора формиата натрия с концентрацией С(HCOONa) = 0,10 моль/л, если раствор разбавить водой в 10 раз. 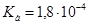 ,
, 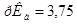 .
.
Задача №19. Рассчитайте константу гидролиза  , степень гидролиза
, степень гидролиза  и рН 0,05 М раствора
и рН 0,05 М раствора 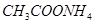 .
. 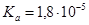 ,
, 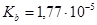 .
.
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 1768; Нарушение авторских прав?; Мы поможем в написании вашей работы!