
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Функциональная роль миостатина
|
|
|
|
Открытие миостатина
Открытие миостатина стало логическим следствием бурного развития молекулярно-генетических методов и фактически совпало с началом формирования нового фронта исследований – функциональной геномики. Во второй половине 90 х был начат поиск в геноме мыши новых генов, которые способны кодировать белки, относящиеся к одному из наиболее важных семейств ростовых факторов, так называемых transforming growth factor ß family (TGFß). Для этой цели были использованы полимеразная цепная реакция с праймерами, которыми стали олигонуклеотиды, комплементарные определенным консервативным участкам в последовательностях известных ростовых факторов данного семейства, а также ряд других молекулярно генетических методов. Далее продукты амплификации (длиной около 280 нуклеотидов) были использованы как зонды для скрининга кДНК библиотеки мышечной ткани мыши.
Переломным моментом в этих поисках стал 1997 год, когда под руководством Se-Jin Lee в Johns Hopkins University School of Medicine, Baltimore удалось выявить ДНК клон, содержащий открытую рамку считывания для последовательности в 376 аминокислот.
Анализ обнаруженной последовательности показал, что она обладает рядом особенностей, характерных для семейства TGFß. Таким образом, авторы вполне обоснованно стали рассматривать обнаруженную ими кДНК последовательность, как продукт гена, кодирующего новый белок из TGFß семейства, и назвали предсказанный продукт фактором TGF 8 (Growth and Differentiation Factor 8 или, в переводе, - фактор роста и дифференцировки N8), а позднее миостатин.
Однако наибольший интерес и внимание вызвали результаты экспериментов, направленных на выяснение функциональной роли TGF 8. Сначала конструирование мышей мутантов по гену миостатина показало, что такие животные по сравнению с обычными достигают существенно большего веса тела (135%).
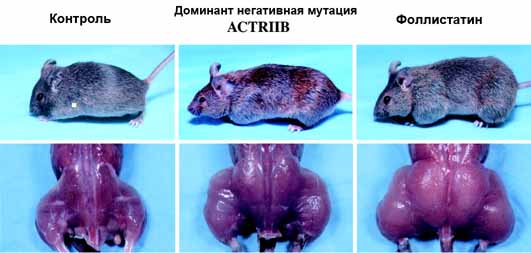
При этом увеличение веса обеспечивалось практически за счет мышечной массы, и вес некоторых мышц у гомозигот более чем в 2 раза превышал вес аналогичных мышц у контрольных животных. Поперечное сечение миофибрилл у мышей нуль мутантов оказалось значительно большим, чем у мышей дикого типа (С57Bl), что указывало на развитие мышечной гипертрофии. В итоге авторы пришли к заключению о том, что миостатин (TGF 8) каким-то образом подавляет рост скелетных мышц, и именно поэтому предложили назвать этот фактор миостатином.

Еще одним объектом для обнаружения генов миостатина были породы мясного скота с фенотипом так называемой «удвоенной мышечной массы». Особи с таким фенотипом («Double muscling») были описаны еще в XIX веке и к настоящему времени хорошо охарактеризованы как специальные породы, например, Belgian Blue или "Бельгийская голубая", Piedmontese и Asturiana de los Valles. Мышечная масса этих животных уже при рождении несколько выше, чем у телят других пород, а вес жировой ткани и костей в процентном отношении снижен. Для взрослых особей с «Double muscling» фенотипом наблюдается ярко выраженное усиление развития скелетной мускулатуры (в среднем на 20% больше, чем у животных других пород), которое обеспечивается в основном за счет гиперплазии – повышенного количества мышечных волокон.

При анализе гена миостатина у Belgian Blue была обнаружена делеция в экзоне 3, охватывающая 11 нуклеотидов (позиции 937–947) и вызывающая сдвиг рамки считывания в функционально важной области, кодирующей зрелый миостатин. Грубо говоря, была выявлена мутация гена миостатина. Более того, у этих коров делеция оказалась в гомозиготном состоянии, то есть они являлись фактически нуль мутациями по гену миостатина, не способными к синтезу миостатина.
Имеются косвенные указания на то, что посттрансляционный процессинг промиостатина обеспечивает металлопротеиназа, действие которой блокируют специфические ингибиторы.
Установлено также, что "зрелый" миостатин секретируется в межклеточную среду и затем оказывается в плазме крови, где тестируется как myostatin immunoreactive protein. По имеющимся данным, основная часть циркулирующего в крови миостатина входит в состав особого белкового олигомерного комплекса, где кроме зрелого миостатина, присутствуют пропептид из 243 аминокислотных остатков (продукт процессинга промиостатина), фоллистатин и фоллистатин родственные белки, о которых речь пойдет позднее.
Как отмечалось ранее, особый интерес к миостатину возник в связи с тем, что уже в самых первых публикациях, посвященных этому фактору, был сделан вывод о том, что миостатин каким-то способом подавляет развитие скелетной мускулатуры, поскольку в его отсутствие наблюдается увеличение мышечной массы за счет гипертрофии и гиперплазии мышечных волокон. В последующем ученые отметили, что при определенных условиях блокирование действия миостатина приводит только к гипертрофии, но не вызывает гиперплазию мышц, тогда как другие авторы сообщили о миссенс мутации в гене миостатина, сопровождающейся гиперплазией мышц мыши при отсутствии признаков гипертрофии. По всей вероятности, эти материалы не столько противоречат друг другу, сколько указывают на сложность и многообразие механизмов, обеспечивающих влияние миостатина на скелетную мускулатуру.
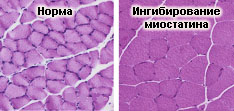 Важно отметить, что по имеющимся данным при блокировании действия миостатина наблюдается не только увеличение мышечной массы, но и повышение силовых характеристик скелетных мышц. С другой стороны, при изучении биологических эффектов миостатина была выявлена корреляция между его высокой продукцией и дистрофическими изменениями скелетной мускулатуры (вплоть до кахексии). Эти результаты вполне соответствовали данным, полученным в опытах на моделях, в частности, на клеточных культурах, где удалось продемонстрировать ингибирование пролиферативной активности миобластов после внесения миостатина в культуральную среду.
Важно отметить, что по имеющимся данным при блокировании действия миостатина наблюдается не только увеличение мышечной массы, но и повышение силовых характеристик скелетных мышц. С другой стороны, при изучении биологических эффектов миостатина была выявлена корреляция между его высокой продукцией и дистрофическими изменениями скелетной мускулатуры (вплоть до кахексии). Эти результаты вполне соответствовали данным, полученным в опытах на моделях, в частности, на клеточных культурах, где удалось продемонстрировать ингибирование пролиферативной активности миобластов после внесения миостатина в культуральную среду.
Более того, было установлено (и для человека, и для многих высших млекопитающих), что миостатин тормозит синтез сократительных и других мышечных белков, в результате чего замедляется формирование скелетных мышц или возникает истощение (кахексия). Вследствие этого появилась гипотеза о том, что по принципу обратной связи миостатин, продуцируемый мышцами, играет роль специфичного физиологического регулятора их роста. Иными словами, миостатин был охарактеризован как один из важных факторов в поддержании равновесия сложных биохимических процессов, которые обеспечивают белковый обмен и связанные с ним процессы формообразования скелетных мышц (гипертрофия и гиперплазия в онтогенезе).
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 1772; Нарушение авторских прав?; Мы поможем в написании вашей работы!