
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Функциональные и конструкционные углеродные наноматериалы
|
|
|
|
Углерод входит в состав главной подгруппы 1V группы периодической системы. Его порядковый номер 6. Электронная конфигурация углeрода 1s22s22p2. На внешней электронной оболочке находится 4 электрона. Углерод не образует отрицательно заряженного иона вследствие малого сродства к электрону. Он также не склонен к образованию положительно заряженного иона из-за большой энергии ионизации. Характерной особенностью углерода является его способность взаимодействовать с другими элементами, образуя соединения с ковалентной (обменной) связью.
По содержанию в земной коре углерод уступает многим элементам. Из общего числа атомов в земной коре на долю углерода приходится лишь 0,14%. Тем не менее значение углерода огромно из-за его исключительной роли в живой природе. Соединения углерода являются основой живых и растительных организмов. Он также входит в состав каменного угля, нефти, природных газов, а также многих минералов.
На земле нет ни одного элемента, который мог бы образовывать такое огромное число соединений (более 3-х миллионов), как углерод.
Углерод является неметаллическим химическим элементом IV группы (C, Si, Ge, Sn, Pb) периодической системы элементов Д.И. Менделеева, поэтому у углерода 4 валентных электрона. Д.И. Менделеев писал, что «ни в одном из элементов такой способности к усложнению не развито в такой мере, как в углероде».
Структуры на основе углерода. В свободном состоянии в природе углерод встречается в виде двух аллотропических модификаций. Способность атомов одного химического элемента соединяться друг с другом различными способами, образуя различные пространственные конфигурации, называется аллотропией.
Углерод в полной мере обладает этим свойством. Действительно, у углерода четыре аллотропические модификации – алмаз (рис.211 а), графит (рис.211 б).
В последние годы обнаружены новые модификации углерода: фуллерены, углеродные нанотрубки, графен, уникальные свойства которых открывают большие возможности в области нанотехнологий.
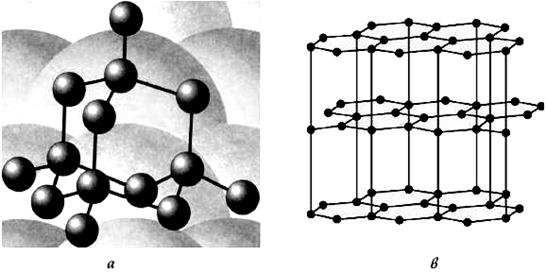
Рис.211 Кристаллическая структура алмаза (а) и графита (б).
Алмаз представляет собой кристалл, в котором каждый атом углерода расположен в центре тетраэдра, вершинами которого служат четыре ближайших атома. Алмаз – самое твердое из всех природных веществ с плотностью 3500кг/м3 (у меди ρ=8920кг/м3). Он сильно преломляет и рассеивает световые лучи, не обладает электрической проводимостью (диэлектрик), плохо проводит тепло. Тугоплавок. Устойчив, к действию кислот и щелочей. Размер природных алмазов колеблется от микроскопических зерен до весьма крупных кристаллов массой в сотни и тысячи каратов (1 карат=0.2г).
Цвет и прозрачность алмазов различны. Встречаются алмазы от безцветных до темных (белые, голубые, зеленые, желтоватые, коричневые, красноватые. В зависимости от качества кристаллов (размера, формы, цвета, числа дефектов, различают два вида алмазов: ювелирные и технические.
У алмаза все четыре валентных электрона атомов углерода образуют высокопрочные ковалентные связи С–С. Их трудно разорвать. Поэтому у него отсутствуют электроны проводимости, и он относится к диэлектрикам. По этой же причине алмаз обладает исключительной твердостью (самое твердое вещество известное на Земле) и высокой температурой плавления (3550оC).
Другой аллотропической формой углерода является графит, сильно отличающийся от алмаза по свойствам. Он представляет серовато-черную массу, жирную на ощупь с плотностью 2200кг/м3. В отличие от алмаза графит очень мягок – легко царапается ногтем и при трении оставляет черные полосы на бумаге. Он хорошо проводит теплоту и электрический ток, подобно металлам. Не пропускает свет.
. Графит – мягкое черное вещество, состоящее из легко слоящихся плоскостей, называемых графеновыми. Расстояние между соседними графеновыми плоскостями в кристалле графита равно 0.34нм, оно больше расстояния между соседними атомами углерода в одной плоскости (0.14нм) примерно в 2,5 раза, вследствие чего связь между атомами углерода в графеновой плоскости гораздо прочнее, чем связь между атомами углерода, находящихся в различных плоскостях.. В пределах графеновой плоскости атомы углерода соединены сильными ковалентными связями. Эти связи образуют двухмерную гексагональную решетку, в основе которой лежит правильный шестиугольник (рис.).
Однако, в отличие от алмаза, в образовании связей участвуют только 3 электрона. Четвертые электроны атомов углерода свободны, те. не локализованы. Это обусловливает хорошую электропроводность графеновых плоскостей (электрическое сопротивление – 0,0014 Ом см). Между графеновыми плоскостями существует слабое притяжение, которое обусловлено силами Ван-дер-Ваальса. Природа этих сил объясняется взаимодействием электронной оболочки атома с положительно заряженным ядром соседнего атома, кулоновское поле которого экранировано собственными электронами. Слабое взаимодействие между плоскостями приводит к тому, что они легко скользят относительно друг друга и могут отслаиваться от графита.
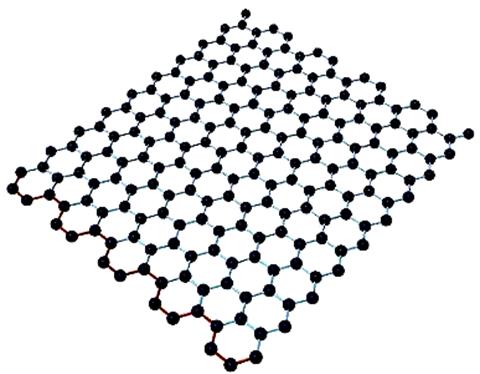
Рис.212 Модель графена.
Хотя графит известен с незапамятных времен, изолированные графеновые плоскости научились получать и исследовать только в 2004 году. Профессор А. Гейм совместно с группой доктора наук К.С. Новоселова (Черноголовка, Россия) сумели получить материал толщиной в один атом углерода. Этот материал, названный графеном, представляет собой двухмерную плоскую молекулу углерода толщиной в один атом (рис.212).
Свойства графена оказались совершенно удивительными. Эффективная масса электронов графена стремится к нулю, поэтому эти электроны обладают большой подвижностью. Их подвижность в сотни раз превосходит подвижность электронов и дырок в кристаллическом кремнии, который является самым распространенным материалом современной микроэлектроники.
Графен позволяет создавать транзисторы и другие полупроводниковые приборы очень малых габаритов (порядка нескольких нанометров). Уменьшение размеров транзистора приводит к изменению его свойств. С уменьшением размеров происходит переход в наномир, где усиливается роль квантовых эффектов. Электроны перемещаются по каналу как волны де Бройля, а это уменьшает количество столкновений (актов рассеяния) и, соответственно, повышает эффективность транзистора, так как уменьшаются потери энергии, неизбежные при рассеянии электронов.
Графен в определенном смысле является ключевой двумерной структурой, дающей с точки зрения квалификации начало разнообразным структурам: трехмерному графиту, двумерным нанотрубкам и нульмерным фуллеренам. Слабое сцепление слов графена в графите уже давно наталкивало исследователей на мысль о том, что графен может быть получен путем расщепления графита. В 2004 году впервые графен был получен путем расщепления графита.
Интерес к графену вызывается тем, что, являясь двумерной системой, он обеспечивает абсолютный предел миниатюризации (т.к. толщина графена эквивалентна одному атомному слою и более тонкого слоя вещества не может быть) и идеальным образом подходит к современным планарным (плоскостным) технологиям создания интегральных электрических схем. С помощью нанолитографии из графена можно вырезать куски произвольной формы и устанавливать на них контактные и бесконтактные электроды. На основе листа графена можно создавать разнообразные периодические структуры.
Графен является полуметаллом. Поэтому при приложении положительного напряжения носителями электрического заряда являются электроны, а при наложении отрицательного напряженияв в графене возбуждается дырочная проводимость. При отсутствии напряжения свободные носители заряда в графене отсутствуют. Подвижность носителей заряда в графене достигает рекордно высоких значений и почти не зависит от концентрации.
Третьей аллотропической формой углерода является карбин, открытый в 60-х годах века. Углерод образует и квазиодномерные структуры.
Карбин представляет линейную структуру, в которой атомы углерода соединены двойными связями (=С=С=) либо чередующимися одинарными и тройными связями. Таким образом, структура карбина одномерная. Эти нити могут формировать углеродные волокна, обладающие большой прочностью и проводящими свойствами. Карбиновые нити могут замыкаться в кольца.
Углеродные нанотрубки. После открытия фуллерена ученые выяснили, что графеновые плоскости могут при определенных условиях сворачиваться в трубки. Эти образования были названы углеродными нанотрубками (УНТ). УНТ – это полые продолговатые цилиндрические структуры диаметром порядка от единиц до десятков нанометров и длиной порядка десятков микрон (рис.). Итак, УНТ это полое образование, состоящее из порядка 1 000 000 атомов углерода.
На ее поверхности атомы углерода расположены в вершинах правильных шестиугольников.
Бездефектную углеродную нанотрубку можно представить себе как лист графита, свернутый в бесшовный цилиндр диаметром от 1 до 150нм и длиной до сотен микрометров.
УНТ сочетают в себе как свойства молекул, так и свойства твердого тела, что позволяет рассматривать их как некое промежуточное состояние вещества. Это один из самых перспективных материалов для разнообразных применений, поскольку они обладают уникальными электрическими и механическими свойствами, включая, прочность, жесткость, ударную вязкость, химическую стойкость, теплопроводность. В зависимости от диаметра и хиральности (направления закрутки) проводимость УНТ может иметь металлический или полупроводниковый характер. Эти свойства в сочетании с наномасштабной геометрией делают их почти идеальными материалами для изготовления квантовых проводов и соединений. Соединяя нанотрубки разного размера и типа, можно создать гетеропереходы, а затем функциональные устройства, вентили и цепи, которые можно назвать изделиями наноэлектроники.
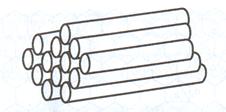
Рис.213 Схема строения сростков УНТ.
Идеальная нанотрубка представляет собой свернутую в цилиндр графеновую плоскость, т. е. поверхность, выложенную правильными шестиугольниками, в вершинах которых расположены атомы углерода. Формы углеродных нанотрубок очень разнообразны. Они могут быть одностенными или многостенными (однослойными или многослойными) (рис. 213), прямыми или спиральными, длинными и короткими и т. д. Нанотрубки необыкновенно прочны на растяжение и на изгиб. Под действием больших механических напряжений они не рвутся, не ломаются, а просто перестраивают свою структуру. УНТ обладают важными для практического использования свойствами: они способны проводить ток очень высокой плотности, менять свои свойства при присоединении (адсорбции) других атомов и молекул, испускать электроны со своих концов при низких температурах (холодная электронная эмиссия) и т.д. Поэтому во всем мире ведутся интенсивные исследования их свойств, что расширяет область их практического использования.
УНТ могут быть открытыми, как это показано на рис.213, и закрытыми. В последнем случае их конец заканчивается половинкой фуллерена, поэтому фуллерены и УНТ являются родственными структурами купольного типа. Ниже представлены снимки УНТ (рис.214), выращенных при двух температурах(при изменении температуры роста: а)  C; б)
C; б) 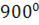 C), сделанные электронным микроскопом.
C), сделанные электронным микроскопом.


Рис.214 УНТ различных размеров, полученные при температурах 7500С и 9000С.

Рис.215. Изображение УНТ в просвечивающем электронном микроскопе
Считается, что нанотрубки открыты в течение всего процесса роста, и атомы углерода присоединяются к открытому концу (рис.216).
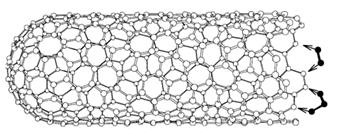
Рис.216 Схема механизма роста углеродной нанотрубки (белые шарики – атомы углерода структуры, черные шарики – димеры C2 и тримеры C3). На открытом конце происходит рост, поглощение C-2 и C-3
Последовательное присоединение димеров C2 (два атома углерода) приводит к непрерывному росту нанотрубок. Иногда требуются тримеры C3 (три атома углерода), чтобы добавлять шестиугольники и не формировать пятиугольники. Введение пятиугольников приводит к искривлению, которое закрыло бы нанотрубку и закончило бы рост. Появление семиугольника приводит к изменениям в размере трубки и её ориентации.
Явление выхода электронов из вещества в вакуум называется электронной эмиссией.
Хорошо известно явление термоэлектронной эмиссии, которое состоит в том, что при нагреве твердого тела до высоких температур, превышающих 10000С, электроны в нем приобретают энергию, достаточную для преодоления работы выхода, и могут выйти в вакуум. На основе термоэлектронной эмиссии изготавливались катоды электронных ламп, которые в течение многих десятилетий определяли развитие электроники.
Меньших энергетических затрат требует холодная эмиссия, при которой электрон выходит в вакуум за счет действия сильного электрического поля. Этот метод не был развит, так как требовал создания очень высоких электрических напряжений. Исследование электронных трубок позволило изменить ситуацию. Радиус одностенной углеродной нанотрубки составляет 0,7 нм. Это позволяет создавать вблизи конца такой трубки электрическое поле более 108 В/см. Энергии таких полей достаточно для выхода электрона в вакуум. Таким образом, эффективность полевой эмиссии электронов из нанотрубок обусловлена их малым диаметром и высокими электрическими полями на концах нанотрубок.
Рис.217. Вакуумный источник света
С технологической точки зрения УНТ хороши тем, что имеют стабильные параметры и высокие плотности тока эмиссии. В дисплеях реализованы плотности эмиссионного тока более 500 мА/см2. Рекордсменами эмиссионных свойств являются одностенные трубки. Это связано с тем, что диаметр их существенно меньше многостенных, а напряженность поля растет обратно пропорционально радиусу острия. Эмиссия используется для создания источников света (рис. 217), экранов дисплеев.
Электрические свойства нанотрубок. С ростом приложенного напряжения происходит увеличение проводимости, поскольку становится доступным большее число каналов для проводимости, но она остается квантованной. Правда, экспериментально это наблюдается при очень низких температурах. Повышение температуры усиливает колебания решетки. Размывается дискретный характер зависимости проводимости от напряжения. Это связано с тем, что термически возбуждается много каналов, ответственных за проводимость трубки (рис. 218).
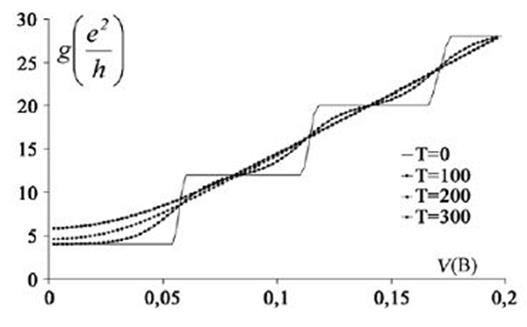
Рис.218. Изменение проводимости углеродной нанотрубки в зависимости от приложенного напряжения
В металлическом состоянии проводимость нанотрубок очень высока. Оценочно они могут пропускать плотность тока до 109A/см2. Медный провод выходит из строя при плотности тока 106А/см2. из-за того, что джоулев нагрев приводит к плавлению провода. Одной из причин высокой проводимости углеродных нанотрубок является очень малое количество дефектов, вызывающих рассеяние электронов, а следовательно, и очень низкое сопротивление. Поэтому большой ток не нагревает трубку так, как он разогревает медный провод. Этому также способствует высокая теплопроводность нанотрубок. Она почти вдвое превышает теплопроводность алмаза, что означает – трубки являются очень хорошими проводниками тепла.
Механические свойства углеродных наноструктур. Ковалентная связь между атомами углерода очень прочная. Поэтому квантовые нити (углеродные нанотрубки) на основе углеродных структур также очень прочны. Было подсчитано, что трос, изготовленный из углеродных структур, может быть спущен со спутника на Землю, и по нему может двигаться лифт. При этом углеродные структуры являются единственным материалом, трос из которого не порвется под собственной тяжестью.
Если к концу вертикальной тонкой проволоки, другой конец которой закреплен, присоединить груз, то проволока растянется. Механическое напряжение в проволоке σ будет пропорционально относительной деформации ε. Причем
ε = Е σ. (13-17)
Коэффициент пропорциональности Е называется модулем Юнга и является свойством конкретного материала, характеризующим его упругость. Чем больше модуль Юнга тем менее податлив материал к действию нагрузки. Модуль Юнга для стали примерно в 3000 раз больше, чем у резины. Для нанотрубки он в десять раз больше, чем у стали. Это подразумевает, что углеродная нанотрубка очень жесткая и трудно сгибается. Однако это не совсем так, т.к. трубка очень тонкая. УНТ очень упруга при изгибе. Она гнется как соломинка, но не ломается. Большинство материалов ломаются при изгибе из-за присутствия дефектов. Так как стенки УНТ имеют высокую степень струтктурного совершенства этого не происходит. Другая причина того, что они не ломаются, состоит в том, что углеродные кольца стенок в виде правильных шестиугольников при изгибе меняют свою структуру, но не рвутся.
Важными механическими свойствами обладают многостенные углеродные нанотрубки, которые представляют собой цилиндры из моноатомных слоёв углерода, вставленные один в другой (рис.215). При этом внутренние цилиндры могут перемещаться относительно внешних практически без трения. Телескопический эффект полностью обратим. Внутреннюю трубку можно вдвигать и выдвигать, и этот процесс можно повторять многократно. При этом действуют силы, которые в случае УНТ складываются из нескольких составляющих: сил Ван-дер-Ваальса, статических и динамических сил трения. Силы трения малы, их экспериментальная оценка дала величину около 10-14 Ньютона на атом. Эксперименты с фрагментом, приведенным на рис.219, показали, что силы трения остаются постоянными с течением времени.
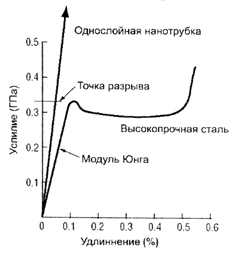
Рис.219
Таблица свойств УНТ
| Характерный размер | Диаметр 0,5-0.8нм | Предел электронной литографии – 7нм |
| Плотность | 1,3-1,4 г/см3 | Алюминий – 2,7 г/см3 |
| Прочность на разрыв | 45 ГПа | Сталь – 2 ГПа |
| Упругость | Упруго изгибается под любым углом | Металлы и волокна ломаются по границам зерен |
| Плотность тока | До 1 109А/cm2 | Медь до 106А/см2 |
| Автоэмиссия | Активируется при 1-3В на расстоянии 1мкм | Молибденовые иглы требуют напряжений 50-100В |
| Теплопроводность | До 6000 Вт (м · К) | Алмаз – 3320 Вт (м ·К) |
Фуллерен. В 1985 году была открыта ранее неизвестная форма углерода – фуллерены (рис. 220). В настоящее время установлено, что элементарный углерод способен образовывать достаточно сложные поверхности, состоящие из различных многоугольников. Эти структуры называют фуллеренами. Фуллерены в конденсированном состоянии называются фуллеритами, а фуллериты, легированные металлами др. присадками, называются фуллероидами.

Рис. 220. Модель фуллерена
Фуллерен представлял собой новую аллотропическую форму углерода. В фуллерене каждый атом углерода соединён тремя прочными химическими связями с другими атомами. Это имеет место и на графеновой плоскости. Однако, в отличие от графена, фуллерен образует выпуклую, замкнутую поверхность, состоящую из правильных шести и пятиугольников. По виду он напоминает футбольный мяч. Форма фуллерена С60 аналогична форме футбольного мяча, также состоящего из 12 пятиугольных и 26 шестиугольных фасеток, поэтому часто фуллерен С60 называют «футболино». Фуллерен назван в честь архитектора Б. Фуллерена, который создавал подобные купола у строящихся помещений.
Фуллерены представляют собой устойчивые многоатомные кластеры углерода с числом атомов от нескольких десятков и выше. Число атомов углерода в таком кластере не произвольно, а подчиняется определенной закономерности (число атомов в кластере N= 32, 44, 50, 58, 60, 70, 72, 78, 80, 82, 84 и т.д. ряд магических чисел для углеродных фуллеренов).
Начиная с восьмидесятых годов были открыты многие фуллерены: С60,С70, …. С600, …, гигантские фуллерены и луковичные структуры, тороидальные и спиральные формы углерода
Форма фуллеренов- полый сфероид, грани которого образуют пяти или шестиугольники. Формы фуллеренов могут быть достаточно разнообразными.
. Наиболее исследованной является молекула фуллерена, которая состоит из 60 атомов и обозначается С60. Фуллерен С60 обладает наибольшей стабильностью и высокой симметрией. Все атомы в этой молекуле эквивалентны, каждый атом принадлежит двум шестиугольникам и одному пятиугольнику. Структура С60 является полым многогранником и содержит 20 шестиугольников и 12 пятиугольников, причем каждый шестиугольник граничит с 3 пятиугольниками и 3 шестиугольниками, пятиугольники граничат только с шестиугольниками. Такая структура обеспечивает молекуле C60 необычайную устойчивость. Свободных связей у молекулы С60 нет, и этим объясняется ее большая химическая и физическая устойчивость. Наличие пятиугольников при построении замкнутых объемных геометрических фигур обязательно, именно они обеспечивают искривление графитовых слоев. Длины C–C связей различаются в зависимости от того, на какой границе они находятся: длина C–C связи на границе шестиугольник-шестиугольник равна 0,139 нм, а длина С–С связи на границе шестиугольник-пятиугольник 0,144 нм. Диаметр молекулы С60 равен 0,7024нм.
Чистый фуллерен является полупроводником с шириной запрещенной зоны более 2эВ.
В центральной области фуллерен С60 полый. Радиус этой полости составляет величину около 0,1058нм. В этой полости могут размещаться атомы других элементов и даже другие молекулы различных материалов, не разрушая целостности самого фуллерена. Так при обработке пленки из фуллеренов парами металла при температуре в несколько сотен градусов Цельсия получаются легированные фуллерены с химическими формулами Х3С60 или ХУ2С60 (Х и У – атомы металлов). Они обладают металлической проводимостью переходят в сверхпроводящее состояние в диапозоне температур от 20 до 55К в зависимости от типа металла. Металлофуллерен CunС60 имеет температуру перехода в сверхпроводящее состояние около 120К, т.е. превышает температуру жидкого азота. Одним из явлений, наблюдаемых в твердых материалах на основе фуллеренов, является сверхпроводимость, причем критическая температура перехода в сверхпроводящее состояние достаточно высока. Еще в 1991 году было установлено, что при легировании твердого C60 небольшим количеством щелочного металла образуется материал с металлической проводимостью, который при низкой температуре переходит в сверхпроводящее состояние.
Уже упоминалось, что в образовании структуры фуллерена принимает участие 3 электрона. Четвертый электрон находится на свободной химической связи. Поэтому данные молекулы обладают важными химическими свойствами. Они могут образовывать полимерные структуры, а также присоединять водород (гидрированные фуллерены), фтор (фторированные фуллерены) и другие атомы.
Шарообразные молекулы С60 могут соединяться друг с другом в твердом теле с образованием ГЦК решетки. В таком кристалле молекулы С60 играют ту же роль, что и атомы в обычном кристалле. Расстояние между центрами ближайших фуллеренов в ГЦК решетке, удерживаемых слабыми силами Ван-дер-Ваальса, составляет около 1нм.
Фуллерены в твердом состоянии называют фул(л)еритами. Твердые фуллериты представляют собой полупроводники. Они являются одними из лучших фотопроводящих органических материалов. Из них можно изготавливать оптические преобразователи, удваивающие и утраивающие частоту падающего света.
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 1777; Нарушение авторских прав?; Мы поможем в написании вашей работы!