
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Cooh - NH3 cooh
|
|
|
|
Ii II
| О |
| СН, —ОН |
СН2— О — С — R, СН2 — О — С — R,
О
+ R,— C—SKoA
СН —О —С —R2 -Л------------- Г^Г СН —О —С —R.
■2
- HSKoA I О
СН2 — О — С — R3
Следует подчеркнуть, что глицерин и жирные кислоты могут быть получены из углеводов. Поэтому при избыточном потреблении углево- ов на фоне малоподвижного образа жизни развивается ожирение.
Полезная информация
Применение карнитина в качестве пищевой добавки позволяет уско- ить вовлечение жирных кислот в р-окисление. Во многих видах спорта использование препарата карнитина позволяет повысить аэробную выносливость. В бодибилдинге карнитин применяют в период тренировок «на рельеф». Благодаря карнитину увеличивается скорость окисления жиров подкожной жировой клетчатки и мышцы становятся более рельефными.
ГЛАВА 7
ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ
С пищей в сутки поступает около 1 г нуклеиновых кислот.
Переваривание их происходит в тонкой кишке. Сначала поступившие с пищей нуклеиновые кислоты (ДНК и РНК) под действием ферментов поджелудочного сока (ДНКаза и РНКаза) превращаются в мо- нонуклеотиды. Затем под влиянием ферментов кишечного сока от мо- нонуклеотидов отщепляется фосфорная кислота и образуются нуклеозиды (состоят из азотистого основания и углевода). Часть нуклеозидов может затем расщепиться на азотистые основания и углеводы.
Продукты переваривания нуклеиновых кислот (азотистые основания, углеводы, фосфорная кислота и нерасщепившиеся нуклеозиды) всасываются в кровь, поступают по воротной вене в печень, а затем в другие органы.
КАТАБОЛИЗМ НУКЛЕИНОВЫХ КИСЛОТ
В клетках организма интенсивно протекает только обмен рибонуклеиновых кислот (РНК), метаболические превращения ДНК протекают очень медленно и в основном только при делении клеток в растущих и регенерирующих тканях.
При распаде внутриклеточные нуклеиновые кислоты, так же как и пищевые, превращаются последовательно в мононуклеотиды, нуклео- 3иДы, фосфорную кислоту, азотистые основания и углеводы. Нуклеози- ДЫ» Поступившие из кишечника, расщепляются на азотистые основания а Углеводы.
Таким образом, из нуклеиновых кислот в конечном счете образуются азотистые основания (пуриновые и пиримидиновые), углеводы (рибоза и дезоксирибоза) и фосфорная кислота.
Схематично распад нуклеиновых кислот может быть представлен следующим образом:
РНК ДНК
 Мононуклеотиды (азотистое основание - углевод - фосфат)
Мононуклеотиды (азотистое основание - углевод - фосфат)
|
Нуклеозиды Фосфорная кислота
(азотистое основание - углевод)
Азотистые основания Углеводы
(пуриновые и пиримидиновые) (рибоза и дезоксирибоза)
Далее пуриновые азотистые основания (аденин и гуанин) в процессе катаболизма дезаминируются (теряют аминогруппу в виде аммиака), окисляются и превращаются в мочевую кислоту:
ОН

|
Образование мочевой кислоты осуществляется в печени. В сутки образуется и выводится с мочой около 1 г мочевой кислоты. Поскольку пуриновые азотистые основания входят в состав и ДНК и РНК, то по выделению мочевой кислоты с мочой можно судить о скорости распада в организме всех нуклеиновых кислот.
Пиримидиновое кольцо в отличие от пуринового менее устойчиво, и поэтому пиримидиновые основания (тимин, урацил, цитозин) подвергаются глубокому распаду до С02, Н20 и NH3.
Углеводы (рибоза и дезоксирибоза) вовлекаются в ГМФ-путь распада углеводов и превращаются в глюкозу.
ё
фосфорная кислота распаду не подвергается. Она может снова использоваться в реакциях фосфорилирования и фосфоролиза или же при избытке выделяется из организма с мочой.
•Д тезнуклЕотидов __________________________________
Все клетки организма способны синтезировать необходимые для них нуклеиновые кислоты и не нуждаются в наличии в пище готовых нуклеиновых кислот или их составных частей. Поэтому содержание нуклеиновых кислот в пище не имеет для организма существенного значения, однако продукты их распада могут частично использоваться.
Синтез пуриновых и пиримидиновых нуклеотидов происходит на основе рибозо-5-фосфата, образующегося из глюкозы при ее распаде по ГМФ-пути. Свободные азотистые основания (пуриновые и пиримидиновые) обычно для этого синтеза не используются.
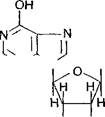
| Гипоксантин |
| сн2о—Р=0 |
| он он Рибоза |
| ОН |
| он |
| Далее из инозиновой кислоты образуются обычные пуриновые нук- леотиды, при этом гипоксантин превращается либо в аденин, либо в Танин. |
При синтезе пуриновых нуклеотидов к рибозо-5-фосфату поочередно присоединяются атомы углерода и азота, из которых образуется пуриновое кольцо. Источниками этих атомов являются аминокислоты: глицин, глутамин, аспарагиновая кислота. Часть атомов углерода поставляется коферментами, содержащими в своем составе витамины Вс (фолиевая кислота) и Н (биотин). Промежуточным продуктом синтеза пуриновых нуклеотидов является инозиновая кислота, содержащая необычное азотистое основание - гипоксантин:
Синтезу пиримидиновых нуклеотидов предшествует образование необычного азотистого основания - оротовой кислоты (ее нет в составе нуклеиновых кислот), содержащей пиримидиновое кольцо:
ОН
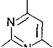 НО 1,1 СООН
Оротовая кислота
НО 1,1 СООН
Оротовая кислота
|
Синтезируется оротовая кислота из аммиака, углекислого газа и ас- парагиновой кислоты. Образовавшаяся оротовая кислота присоединяется к рибозо-5-фосфату и возникает пиримидиновый нуклеотид - оро- тидинмонофосфат. Далее оротовая кислота в составе этого нуклеотида преобразуется в обычные азотистые основания - тимин, урацил и цито- зин, в результате чего появляются пиримидиновые нуклеотиды (тими- динмонофосфат - ТМФ, уридинмонофосфат - УМФ и цитидинмоно- фосфат - ЦМФ), входящие в состав нуклеиновых кислот.
В связи с такой важной ролью оротовой кислоты в синтезе нуклеотидов в спортивной практике в качестве пищевой добавки нередко применяется оротат калия.
Дезоксирибонуклеотиды (содержат дезоксирибозу) образуются из соответствующих рибонуклеотидов путем восстановления входящей в них рибозы в дезоксирибозу.
СИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ
Для синтеза нуклеиновых кислот используются мононуклеотиды обязательно в трифосфатной форме. Такие нуклеотиды содержат в своей молекуле три остатка фосфорной кислоты и обладают повышенным запасом энергии. Переход нуклеотидов в трифосфатную форму осуществляется путем взаимодействия с АТФ.
Для синтеза РНК необходимо четыре вида рибонуклеотидов (АТФ, ГТФ, УТФ и ЦТФ). Для синтеза ДНК используются дезоксирибонуклеотиды тоже четырех видов (д-АТФ, д-ГТФ, д-ТТФ и д-ЦТФ).
Синтез ДНК (репликация) интенсивно протекает во время клеточного деления. В процессе репликации в молекуле ДНК (родительская молекула) разрываются водородные связи между азотистыми основаниями обеих ее нитей, что приводит к раскручиванию двойной спирали
ДНК и образованию двух свободных нитей. К образовавшимся свободным нитям, как к матрицам, подходят нуклеотиды в трифосфатной форме и своими азотистыми основаниями с соблюдением принципа комплементарное™ (аденин - тимин и гуанин - цитозин) присоединяйся к ним. Благодаря этому принципу создается нужная последовательность расположения нуклеотидов. По мере присоединения к матрице нуклеотиды связываются в полинуклеотидные нити, которые сразу же закручиваются с матрицей в двойную спираль. При этом от каждого нуклеотида отщепляется по два остатка фосфорной кислоты в форме дифосфата. В конечном счете на каждой матрице возникает новая нить, которая по строению точно соответствует второй нити ДНК. В результате репликации синтезируются две новые молекулы ДНК (дочерние), которые являются точной копией родительской молекулы ДНК. В дочерних молекулах одна полинуклеотидная нить происходит из родительской молекулы, а другая синтезирована из нуклеотидов в процессе репликации.
Синтез РНК (транскрипция) также протекает с участием ДНК. В процессе транскрипции раскручивается только ограниченный участок ДНК и матрицей служит лишь одна освободившаяся нить ДНК. К этой нити, как к матрице, подходят нуклеотиды в трифосфатной форме, содержащие рибозу, и по принципу комплементарности располагаются в строго определенном порядке. Затем нуклеотиды соединяются в полинуклеотид, и от каждого из них отщепляется ди- фосфат. Образовавшаяся полинуклеотидная цепь с матрицей двойной спирали не образует и легко отходит от молекулы ДНК, после чего происходит восстановление ее двойной спирали. Таким образом происходит синтез информационных (иРНК), транспортных (тРНК) и рибосомных (рРНК) РНК.
Полезная информация
Диффузия - самопроизвольное движение молекул из области высокой концентрации в направлении более низкой. Обусловлена диффузия тем, что все молекулы постоянно находятся в состоянии беспорядочного, хаотичного движения. Следствием диффузии является выравнивание концентрации.
ГЛАВА 8 ОБМЕН БЕЛКОВ
В сутки с пищей поступает около 100 г белков.
Переваривание белков осуществляется протеолитическими ферментами желудочного, поджелудочного и кишечного соков, причем ферменты желудочного и поджелудочного соков вырабатываются в неактивной форме (в виде проферментов) и активируются непосредственно в полости желудочно-кишечного тракта. Это предупреждает нежелательное воздействие данных ферментов на белки клеток пищеварительных желез, где происходит их образование.
Под действием протеолитических ферментов в молекулах пищевых белков расщепляются пептидные связи, т. е. протекает протеолиз. В результате совместного действия всех протеолитических ферментов пищевые белки превращаются в аминокислоты. В сутки из белков пищи образуется примерно 100 г аминокислот.
Всасывание аминокислот происходит по системе воротной вены.
КАТАБОЛИЗМ БЕЛКОВ
Белки, входящие в состав клеток организма, также подвергаются постоянному распаду под влиянием внутриклеточных протеолитических ферментов, называемых внутриклеточными протеиназами или катепсинами. Эти ферменты локализованы в специальных внутриклеточных органоидах — лизосомах. Под действием катепсинов белки организма также превращаются в аминокислоты. (Важно отметить, что распад как пищевых, так и собственных белков организма приводит к образованию одних и тех же 20 видов аминокислот.) В сутки расщепляется примерно 200 г белков организма. Поэтому в течение суток в организме появляется около 300 г свободных аминокислот.
СИНТЕЗ БЕЛКОВ
Большая часть аминокислот используется для синтеза белков. В организме взрослого человека существует равновесие между распадом и синтезом белков. У детей преобладает синтез, ведущий к накоплению белков в организме, что является обязательным условием роста и развития организма.
Синтез белков происходит при обязательном участии нуклеиновых кислот.
Первый этап синтеза белка - транскрипция - осуществляется в клеточном ядре с использованием ДНК как источника генетической информации. Генетическая (наследственная) информация обусловливает порядок расположения аминокислот в полипептидных цепях синтезируемого белка. Эта информация закодирована строгой последовательностью азотистых оснований мононуклеотидов в молекуле ДНК. Каждая аминокислота кодируется сочетанием трех азотистых оснований, называемым кодоном, или триплетом. Участок молекулы ДНК, содержащий информацию об определенном белке, получил название «ген». На этом участке ДИК во время транскрипции по принципу ком- плементарности синтезируется информационная РНК (иРНК), (см. главу 7 «Обмен нуклеиновых кислот»). Эта нуклеиновая кислота представляет собой копию соответствующего гена. Следовательно, иРНК содержит информацию о строении белка, закодированного в данном гене. Образовавшаяся иРНК выходит из ядра и поступает в цитоплазму.
Аналогичным образом на ДНК как на матрице происходит синтез рибосомных (рРНК) и транспортных (тРНК) РНК.
В ходе второго этапа — рекогниции (распознования), протекающего в цитоплазме, аминокислоты избирательно связываются со своими переносчиками - транспортными РНК (тРНК).
Все тРНК (их обнаружено около 60) построены сходным образом. Молекула каждой тРНК представляет собой короткую полинуклеотид- ную цепь, содержащую примерно 80 нуклеотидов и частично закрученную в двойную спираль, что приводит к возникновению пространственной конфигурации «изогнутого клеверного листа» (рис. 7). На одном конце полинуклеотидной цепи у всех тРНК находится нуклеотид, содержащий аденин. К этому концу молекулы тРНК присоединяется аминокислота. Петля, противоположная месту присоединения аминокислоты, содержит антикодон, состоящий из трех азотистых оснований и предназначенный для последующего связывания с комплементарным кодоном иРНК. Одна из боковых петель молекулы тРНК обеспечивает присоединение тРНК к ферменту, участвующему в рекогни- ВДи> а другая, боковая, петля необходима для присоединения тРНК к рибосоме на следующем этапе синтеза белка.
На этом этапе в качестве источника энергии используется молекула АТф. в результате рекогниции образуется комплекс аминокислота- ТРНК (аминоацил-тРНК):
аминокислота + тРНК ---------- аминоацил-тРНК
ь
составе этого комплекса аминокислота обладает повышенной химической активностью. В связи с этим второй этап синтеза белка часто бывают активацией аминокислот.
Третий этап синтеза белка - трансляция - происходит на рибосомах. Каждая рибосома состоит из двух частей - большой и малой субчастиц. По химическому составу обе субчастицы представляют собою нук- леопротеиды, состоящие из рибосомных РНК и белков. Рибосомы способны легко распадаться на субчастицы (диссоциация), которые снова могут соединяться друг с другом, образуя рибосому (ассоциация).
Трансляция начинается с диссоциации рибосомы на субчастицы, которые сразу же присоединяются к начальной части молекулы информационной РНК, поступающей из ядра. При этом между субчастицами остается пространство (так называемый туннель), где располагается небольшой участок иРНК.
Затем к образовавшемуся комплексу рибосома - иРНК присоединяются тРНК, связанные с аминокислотами. Присоединение тРНК к этому комплексу происходит путем связывания одной из боковых петлей тРНК с рибосомой и связывания антикодона тРНК с комплементарным ему кодоном иРНК, находящимся в туннеле между субчастицами рибосомы. Одновременно к комплексу рибосома - иРНК могут присоединиться только две тРНК с аминокислотами.
Благодаря специфическому связыванию антикодонов тРНК с ко донами иРНК, к участку молекулы иРНК, находящемуся в туннеле, присоединяются только молекулы тех тРНК, у которых антикодоны комплементарны кодонам иРНК. Поэтому эти тРНК доставляют в рибосомы только строго определенные аминокислоты. Далее аминокислоты соединяются друг с другом пептидной связью и образуется дипептид, который связан с одной из тРНК. После этого рибосома передвигается вдоль иРНК ровно на один кодон (это перемещение рибосомы называется траислокацией).
В результате транслокации свободная (без аминокислоты) тРНК отщепляется от рибосомы, а в зоне туннеля появляется новый кодон, к которому присоединяется по принципу комплементарности еще одна тРНК с аминокислотой, соответствующей этому кодону. Доставленная аминокислота соединяется с ранее образовавшимся дипептидом, что приводит к удлинению пептидной цепи. Далее следуют новые транслокации, поступление на рибосому новых тРНК с аминокислотами и дальнейшее удлинение пептидной цепи.
Антикодон
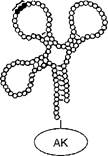 Рис. 7. Схема строения аминоацил-тРНК
Рис. 7. Схема строения аминоацил-тРНК
|
Таким образом порядок включения аминокислот в синтезируемый белок определяется последовательностью ко донов в иРНК.
Завершается синтез полипептидной цепи при поступлении в туннель особого кодона, который не кодирует аминокислоты и к которому не может присоединиться ни одна тРНК. Такие кодоны называются терминирующими, или нонсенс-кодонами. Особенно велика их роль в синтезе белков, молекула которых состоит из нескольких полипептидов.
В итоге за счет описанных трех этапов синтезируются полипептиды, т. е. формируется первичная структура белка. Высшие (пространственные) структуры (вторичная, третичная, четвертичная) возникают самопроизвольно. Это объясняется тем, что пространственные структуры фиксируются в основном химическими связями, возникающими между радикалами аминокислот. Поэтому в каждом белке эти связи образуются специфически в соответствии с генетически обусловленной последовательностью расположения радикалов в полипептидных цепях.
В некоторых случаях полипептидная цепь после завершения синтеза подвергается незначительной химической модификации, в результате чего в ней появляются некодируемые аминокислоты (не относящиеся к 20 обычным аминокислотам). Например, при синтезе белка коллагена на рибосомах образуется его предшественник - проколлаген, содержащий в большом количестве аминокислоты лизин и пролин. Эти аминокислоты, находящиеся в составе полипептидной цепи, подвергаются в ходе модификации окислению и превращаются соответственно в окси- лизин и оксипролин, что приводит к переходу проколлагена в коллаген.
Синтез белков - процесс энергоемкий. Для включения в молекулу синтезируемого белка только одной аминокислоты требуется не менее трех молекул АТФ.
В очень небольших количествах белки еще синтезируются в митохондриях, где также имеются ДНК, иРНК, тРНК и рибосомы.
Синтез белков в организме ускоряется соматотропным гормоном (гормоном роста) и тестостероном (мужским половым гормоном). Тормозится синтез белков гормонами коры надпочечников - глюко- кортикоидами. Регулирующее действие всех этих гормонов связано с их влиянием на скорость транскрипции.
Синтез белков подавляют многие антибиотики, ингибирующие трансляцию.
Метаболизм аминокислот__________________________
Помимо синтеза белков аминокислоты еще используются для син- Теза различных небелковых соединений, имеющих важное биологиче- ск°е значение. Так, из аминокислот синтезируется глюкоза, азотистые 0сНования, небелковая часть гемоглобина - гем, гормоны адреналин
и тироксин и очень важное соединение, участвующее в энергообеспечении мышечной работы, - креатии.
Часть аминокислот подвергается распаду и превращается в конечные продукты: С02, Н20 и NH3.
Распад начинается с реакций, общих для большинства аминокислот. К ним относятся:
а) декарбоксилирование - отщепление от аминокислот карбоксильной группы в виде углекислого газа:
R R
Н —С —NH2 _______ ^ Н — C — NH2
I - со2 I
СООН H
Амин
б) дезаминирование - отщепление аминогруппы в виде NH3. У человека дезаминирование аминокислот идет окислительным путем:
R R
I I
H-C-NH2 +1/2 0, С = 0
I 1 I
а-кетокислота
в) трансаминирование (переамииирование) - реакция между аминокислотами и а-кетокислотами. В ходе этой реакции ее участники обмениваются функциональными группами, в результате чего аминокислота превращается в а-кетокислоту, а кетокислота становится аминокислотой:
R1 R, R-i R,
II II
H-C-NH, + С = 0 --------- — С = 0 + H-C-NH,
II II
СООН СООН СООН СООН
Трансаминированию подвергаются все аминокислоты. В этой реакции участвует кофермент - фосфопиридоксаль, для образования которого необходим витамин В6 - пиридоксин.
Трансаминирование - это главное превращение аминокислот в организме, так как его скорость значительно выше, чем у реакций декар- боксилирования и дезаминирования.
Трансаминирование выполняет две основные функции:
| w |
а) за счет трансаминирования одни аминокислоты могут превращаться в другие. При этом общее количество аминокислот не меняется, но изменяется соотношение между ними. С пищей в организм посту
пают чужеродные белки, у которых аминокислоты находятся в иных пропорциях по сравнению с белками организма. Путем трансаминиро- вания происходит корректировка аминокислотного состава организма.
б) является составной частью косвенного (непрямого) дезамини- рования аминокислот - процесса, с которого начинается распад большинства аминокислот. На первой стадии этого процесса аминокислоты вступают в реакцию трансаминирования с а-кетоглутаровой кислотой (а-кетокислота). Аминокислоты при этом превращаются в а- кетокислоты, а а-кетоглутаровая кислота переходит в глутаминовую кислоту (аминокислота). На второй стадии появившаяся глутаминовая кислота подвергается дезаминированию, от нее отщепляется NH3 и снова образуется а-кетоглутаровая кислота.
Схема косвенного дезамипирования СООН
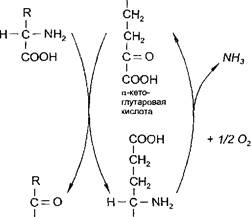 СООН
Глутаминовая кислота
СООН
Глутаминовая кислота
|
| СООН |
Итоговое уравнение косвенного дезаминирования совпадает с уравнением прямого дезаминирования:
| R I C-NH-,СООН |
| R I с = о I СООН |
| Н- |
| + 1/2 О 2 ~nh' |
Отсюда следует, что реакцией, с которой начинается распад амино-
| 1С11СЛот в организме, является трансаминирование. |
65
Образовавшиеся а-кетокислоты далее подвергаются глубокому распаду и превращаются в конечные продукты С02 и Н20. Для каждой из 20 кетокисло! (их образуется столько же, сколько имеется видов аминокислот) имеются свои специфические пути распада. Однако при распаде некоторых аминокислот в качестве промежуточного продукта образуется пировиноградная кислота, из которой возможен синтез глюкозы. Поэтому аминокислоты, из которых возникают такие кетокислоты, получили название глюкогенные. Другие же кетокислоты при своем распаде не образуют пирувата. Промежуточным продуктом у них является ацетилкофермент А, из которого невозможно получить глюкозу, но зато могут синтезироваться кетоновые тела. Аминокислоты, соответствующие таким кетокислотам, называются кетогенные.
Второй продукт косвенного дезаминирования аминокислот - аммиак. Для организма аммиак является высоко токсичным. Поэтому в организме имеются молекулярные механизмы его обезвреживания.
По мере образования NH3 связывается во всех тканях с глутамино- вой кислотой с образованием глутамина:
conh2
I
сн2
I
СН,
------------ — I
| ■ н3ро4 |
- адф н - с - nh2
соон
| соон I сн2 СН, |
| + nh, + атф |
| h-c-nh2 СООН Глутаминовая кислота |
Глутамин
Это временное обезвреживание аммиака. С током крови глутамин поступает в печень, где распадается опять на глутаминовую кислоту и NH3. Образовавшаяся глутаминовая кислота с кровью снова поступает в органы для обезвреживания новых порций аммиака. Освободившийся аммиак, а также углекислый газ в печени используются для синтеза мочевины.
Синтез мочевины - циклический, многостадийный процесс, потребляющий большое количество энергии. В синтезе мочевины очень важное участие принимает аминокислота орнитии. Эта аминокислота не входит в состав белков. Образуется орнитин из другой аминокислоты - аргинина, который присутствует в белках. В связи с важной ролью орнитина синтез мочевины получил название орни- тиновый цикл.
в процессе синтеза к орнитину присоединяются две молекулы аммиака и молекула углекислого газа, и орнитин превращается в ар-
гинин, от которого сразу же отщепляется мочевина, и вновь образуется орнитин:
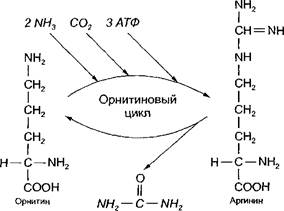 Мочевина
Мочевина
|
Наряду с орнитином и аргинином в образовании мочевины еще участвуют аминокислоты: глутамин и аспарагиновая кислота. Глутамин является поставшиком аммиака, а аспарагиновая кислота его переносчиком.
Синтез мочевины - это окончательное обезвреживание аммиака. Из печени с кровью мочевина поступает в почки и выделяется с мочой. В сутки образуется 20-35 г мочевины. Выделение мочевины с мочой характеризует скорость распада белков в организме.
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 668; Нарушение авторских прав?; Мы поможем в написании вашей работы!