
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение и структурная организация белков
|
|
|
|
Аминокислоты образующие белки называются протеогенными
Специфический радикал аминокислот придает им различные свойства, которые обогащают структурные и функциональные возможности белка. По природе радикала протеогенные аминоскислоты можно разделить на несколько групп:
- алифатические
- оксиаминокислоты
- серосодержащие аминокислоты
- моноаминодикарбоновые
- диаминокарбоновые
- ароматические
- иминокислоты
По питательной ценности аминокислот, входящих в состав белка их можно разделить на заменимые и незаменимые. Незаменимые неспособны синтезироваться в организме человека и животного. К ним относятся: валин, лейцин, изолейцин, трианин, метианин, лизин, аргенин, фенилаланин, триптофан, гистидин. Карбоксильная группа одной аминокислоты реагирует с аминогруппой другой аминокислоты с выделением молекулы воды, при этом возникает пептидная связь. В образовании пептидной связи принимает участие только альфа СООН и альфа NH2 группы. Неспецифическая часть придает всем аминокислотам общее свойство - способность к диссоциации. NH2 придает основные свойства белкам, СООН придает кислотные свойства белкам. Таким образом, в связи с наличием этих группировок они способны диссоциировать и как кислоты и как основания. В водной среде аминокислоты всегда несут и положительный и отрицательный заряды. Преобладающий заряд зависит от рН-среды. Кислая среда стимулирует основную диссоциацию, в результате которой амфолит приобретает положительный заряд. В щелочной среде обратная картина. При определенном значении рН степень кислотной и основной диссоциации уравнивается и аминокислота становится електронейтральной, это значение рН называется изоэлектрической точкой (ИЭТ). В этой точке белок неустойчив и выпадает в осадок так как белок теряет заряд. Известно, что ИЭТ цитоплазмы клетки лежит в кислой среде, а ИЭТ ядра - в щелочной. Значение ИЭТ может характеризовать ф-циональную активность клетки. В активные периоды онтогенеза ИЭТ находится при рН от 2 до 5.
Структура белков:
- Первичная - последовательность аминокислотных остатков в белковой полипептидной цепи.
- Вторичная или альфаструктура белка - создается благодаря дополнительным водородным связям. В результате полипептидная цепочка закручивается по альфа-спирали.
- Третичная - это упаковка во внешней среде (конформация). Бывает глобулярным и фибриллярным.
- Четвертичная - молекулы многих белков состоят из нескольких полипептидных цепочек, соединенных между собой непептидными связями. Классическим примером является гемоглобин, молекулы которого состоят из четырех полипептидных цепочек.
Высалевания. Для нормального функционирования молекула белка всегда должна быть в заряженном состоянии и окружена так называемой гидратационной оболочкой, которая образует диполи воды. При добавлении концентрированных солей наблюдается потеря гидратационной оболочки молекулы белка и белок выпадает в осадок, но процесс обратим, при добавлении воды эта оболочка вновь восстанавливается. Денатурация - это одно из наиболее характерных св-в белков. При определенных условиях внутреннее строение полипептидных цепей изменяется. В их молекулах разрываются некоторые связи и белки переходят в другое качественное состояние, при этом белковая молекула претерпевает изменения, связанные с изменением вторичной, третичной и четвертичной структур белка. Причина денатурации - разрушение связей стабилизирующих вторичную, третичную и четвертичную структуры белка. Различают обратимую и необратимую денатурации.
Классификация белков: простые - это протеины, сложные - протеиды. Липопротеиды - те в которые входят различные жироподобные вещества. Хромопротеиды (окрашены) - типичный представитель гемоглобин. Гликопротеиды - связаны с углеводами. Нуклеопротеиды - группа сложных белков где белок связан с нуклеиновыми кислотами.
4. Ф-ции белков - участвуют во всех аспектах жизни клеток:
- Структурная - более половины сухой массы цитоплазмы и ее органелл принадлежит белкам. Основа строения клетки - биологические мембраны, наполовину построенные из белков.
- Ферментативная ф-ция - все биокатализаторы хим. реакций в клетке являются белками.
- Транспортная - некоторые белки находящиеся в клеточной мембране участвуют в транспорте веществ.
- Запасная - белок представляет собой высоковосстановленное соединение с большим запасом энергии.
- Имунная (защитная) - роль белков в защите растения от инфекций велика и разнообразна. Различные по имунным св-вам объекты отличаются как по количеству и качеству белков, имеющихся в здоровом организме, так и по тем изменениям, которые происходят в белковом спектре после заражения. В качественном отношении белки устойчивых форм часто имеют в своем составе много аминокислот, плохо переносимых тем или иным патогеном. Фитофтора, к примеру, не любит большого содержания аргенина в белках. В структурном отношении наиболее активно противостоят инфекции антиферменты, которые способны ингибировать ферменты паразита. По отношению к веществам углеродной природы это белки лектины, которые находятся на поверхности мембран. Они очень специфичны и способны распознать отдельные штамы бактерий. Лектины связывают патогенные бактерии, образуя при этом как бы тромб, предотвращающий их дальнейшее распространение.
ТЕМА: "Ферменты"
1. История развития учения о ферментах. Роль ферментов в обмене веществ
2. Классификация и номенклатура ферментов.
3. Механизм действия ферментов
4. Строение ферментов
5. Свойства ферментов
6. Скорость ферментативной реакции. Активаторы и ингибиторы ферментов
7. Оксидоредуктазы. Катализируемые реакции
8. Трансферазы
9. Гидролазы
10. Лиазы
11. Изомеразы
12. Лигазы (синдетазы)
13. Изоферменты
14. Особенности ферментов в период онтогенеза растений.
15. Условия внешней среды биоферментов
1. Начало изучения ферментов относится к 1814 году, когда русский ученый Киргоф показал, что в прорастающем зерне содержится вещество, способное превращать крахмал в сахар. В 1833 году Пайонд и Персо выделили из солода это вещество и назвали его ДИАСТАЗОЙ. В 1926 году Саммер впервые получил ферменрт УРИАЗУ в кристаллическом виде. В настоящее время учение о ферментах превратилось в интенсивно развивающуюся науку - ЭНЗИМОЛОГИЮ или ферментологию, которая тесно связана со многими биологическими науками. Роль ферментов в обмене веществ заключается в том, что они способны увеличивать скорость реакции до сотни тысяч и миллионы раз. Все биохимические реакции в клетке протекают с участием ферментов.
2. Согласно классификации каждый фермент имеет рациональное нащвание и шифр, состоящий из четырех цифр. В шифре первая цифра обозначает класс, вторая - подкласс, третья - еще более мелкую группу ферментов подподкласс, четвертая - обозначает данный конкретный фермент. Ферментыобычно заканчиваются окончанием -АЗА, за исключением тривиальных названий: пепсин, трипсин, попаин и т.д. В Систематическое название ферментов часто включается и субстрат и фермент. Главгым специфическим признаком, на основании которого один фермент отличается от другого, является химическая ракция, катализируемая данным ферментом.
3. Сущность ферментативной реакции сводится к тому, что фермент связывается с субстратом с образованием фермент-субстратного комплекса, который затем распадается с образованием продуктов реакции и свободного фермента. Для того чтобы произошла химическая реакция системе необходимо передать некоторое количество энергии. Количество энергии необходимое для протекания зимической реакции называется энергией активации. Согласно законам химической кинетики чем ниже энергия активации, тем быстрее протекают реакции.
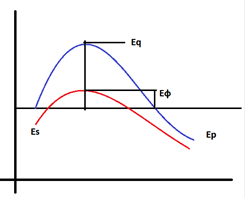
Es- энергия субстрата в состоянии покоя
Eq- энергия активации без фермента
Еф - энергия активации с ферментом
Ер - продукты распада
За счет чего ферменты способны значительно снижать энергию активации? Все ферментативные реакции протекают в три этапа:
На первом этапе фермент соединяется с субстратом и образует фермент-субстратный комплекс.
На втором этапе происходит ослабление хмических связей между оперделенными атомами, это протому что фермент вызывает в нем поляризацию - смещение электронов или электронного облака.
На третьем этапе за счет дополнительной энергии активации происходит разрыв определенных химических связей в субстрате с образованием продуктов распада субстрата и фермент.
4. Все ферменты делятся на однокомпонентные и двухкомпонентные. Однокомпонентные - состоят только из белка. Двухкомпонентыне состоят из белка и небелковой части, которая называется простетической или активной группой. Если небелковая часть легко отделяется от белковой, ее называют Коферментом. В состав простетической группы могут входить металлы, неметаллы, витамины.
5. Ферменты по сравнению с неорганическими катализаторами обладают более высокой активностью.
1. Специфичность действия - каждый фермент катализирует только конкретную реакцию. Различают химическую или абсолютную специфичность, когда определенный фермент действует на определенное химическое вещество.
2. Групповая специфичность - когда фермент действует на определенные химические связи.
3. Стереохимическая специфичность - когда фермент катализирует расщепление определенных стереоизомеров.
Обратимость действия - ферменты способны катализировать реакции как в прямом так и в обратном направлении.
Лабильность - способность подстраиваться под определенные условия.
6. На скорость ферментативной реакции в значительной степени влияют внешние условия.
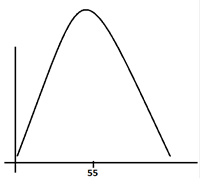
Температура. С увеличением на 10 градусов по шкале Цельсия скорость ферментативной реакции увеличивается в 1,4-2 раза, чем оббъясняется возрастание кинетической энергии молекул. Оптимум ферментативной реакции приходится 55-60 градусов, после чего начинается быстрый спад, связанный с денатурациями белка.
Значение рН-среды. Шкала рН от 1 до 14. Каждый фермент имеет свой оптимальный рН среды. Большинство ферментов проявляют максимальную активность близкой в нейтриальной или слабокислой среде. Снижение или повышение рН вызывает сдвиг диссоциации групп, участвующих в стабилизации структуры. Нарушение электростатистических взаимодействий привдоит к изменению конформации фермента и потере каталитических свойств. Для каждого фермента свой рН.
При постоянной концентрации субстрата и при увеличении концентрации фермента скорость ферментативной реакции увеличивается прямопропорционально.
Концентрация субстрата: зависимость скорости ферментативной реакции от концентрации субстрата (при постоянном количестве фермента) может быть выражена графически:
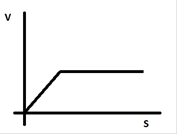
С увеличением количества субстрата скорость роеакции растет так как все большее число молекул фермента взаимодействуют с молекулами субстрата, осуществляя ее катализ. Когда все молекулы фермента будут вовлечены в данную реакцию, будет выравнивание скорости реакции. Таким образом скорость реакции достигает максимального значения при определенной концентрации субстрата.
Уравнение Константа Михаэлиса:
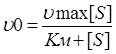
Уравнение выражает количественное отношение между начальной скоростью реакции, максимальной скоростью реакции и исходной концентрации субстрата, связанных между собой через константу Михаэлиса (Км).
Константа Михаэилса показывает концентрацию субстрата, когда скорость ферментатитвной реакции равна половине от максимальной.
Для измерения количества фермента и его активности используется ряд показателей:
Единица активности фермента - это количество фермента, катализирующее превращение 1 моль субстрата за 1 минуту.
Удельная активность - число единиц фермента на 1 грамм белка.
Молярная активность - число единиц фермента на 1 мкмоль белка.
8. Активаторы и ингибиторы фрементов.
Вещества усиливающие каталитическую активность ферментов называются активаторами. Чаще всего роль активаторов ферментов выполняют ионы металлов (Натрий, калий, кальций, молибден, медь, марганец). Иногда для активации ферментов требуется несколько ионов. Активаторами ферментов могут быть и другие вещества: йод, бром, хлор и т.д. Существуют вещества которые подавляют действие ферментов. Их называют ингибиторами. Если подавить деятельность какого-либо одного фермента или группы ферментов, то соответственно ослабляется или прекращается течение одного или нескольких биохимических процессов. Происходит серьезное нарушение в обмене веществ и даже гибель организма.
Ферментативные ингибиторы делятся на две группы: общие ингибиторы и специфические. К общим относятся соли тяжелых металлов (свинец, серебро, ртуть, вольфрам). Наибольшее значение имеют специфические ингибиторы, которые действуют на один фермент или группук ферментов. Механизм действия этих ингибиторов заключается в том, что они, соединяясь, блокируют активные группы (или активные центры) молекул ферментов.
Все ферменты деляться на 6 классов:
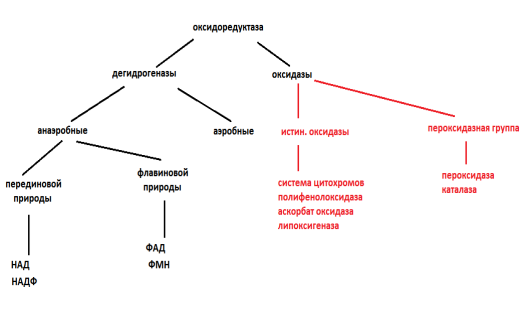
- оксидоредуктазы - переносят протон или электрон от одного субстрата к другому, участвуют во всех процессах биологического окисления.
RH2 + A = R+AH2 (перенос протона)
оксидоредуктазы делятся на анаэробные дегидрогеназы и аэробные дегидрогеназы (к этому классу относятся разнообразные ферменты, катализирующие окислительно-восстановительные реакции, происходящие в живом организме)
Среди этих ферментов прежде всего нужно назвать дегидрогеназы, катализирующие реакции дегидрирования (например алкогольдегидрогеназа), то есть отнятие водорода от данного органиеского соединения. Реакция дегидрирования может быть изображена следующим образом.
АН2 +В =А + ВН2
В живых клетках роль промежуточных переносчиков водорода выполняют различные дегидрогеназы. Анаэробные дегидрогеназы, которые не могут отдавать водород кислороду воздуха, а могут передать его другим акцепторам (например другим дегидрогеназам или хиноноподобным соединениям). Анаэробные дегидрогеназы являются двухкомпонентными, бывают Пиридиновой и Флавиновой природы. Коферментом у первых является НАД (никотинаминодениндинуклеотид) или НАДФ.(никтоинамидодениндинуклеотидфосфат) - производные витамина РР (никотиновая кислота). Коферментом у вторых может быть ФМН (флавинмононуклеотид) и ФАД (флавинадениндинуклеотид) - производные витамина В2.
Аэробные дегидрогеназы - ферменты способны отнятый от субстрата водород передавать сразу на кислород воздуха. Аэробные дегидрогеназы бывают только флавиновой природы. В отличии от анаэробных в своем составе не содержат металл, поэтому не ингибируются ингибиторами, а потому их называют ферментами остаточного дыхания. Помимо дегидрогеназ в растениях присутствуют оксидазы которые способны передавать водород в основном кислороду воздуха. Отнимая водород от окисляемого субстрата и передавая его кислороду, оксидаза может образовать при этом воду или перекист водорода. Эти ферменты заканчивают собой цепь передачи водорода и электрона, они иначе называются терминальными ферментами. Сюда относятся: системы цитохромов и цитохромоксидазы, полифенолоксидазы и аскорбатоксидазы, гликолатоксидазы и т.д. Цитохромы представляют собой двухкомпонентные ферменты, основу строения которых составляет порфириновое ядро. В центре этого ядра находится Fe. Изменение валентности Fe от 2 до 3 определяет основные свойства цитохромов. Полифенолоксидаза - фермент окисляющий фенолы и их производные, в центре находится Cu (медь). Помимо этих оксидаз в растениях существует еще одна система - пероксидазная система. Пероксидаза играет большую роль в процессе дыхания растений. Этот фермент двухкомпонентынй, активной частью которого является железо-порфирин. Пероксидаза использует для окисления не молекулярный кислород, а перекись водорода, утилизируя ее до воды и атомарного кислорода. Активность этого фермента свидетельствует о повышенном иммунном статусе данного организма.
Каталаза - фермент который разлагает пероксид водорода на воду и на молекулярный кислород. Каталаза так же имеет простатическую группу (активный центр) - железопорфирин.
В растениях широко распространен фермент липоксигеназа - катализирует окисление кислородом воздуха некоторые ненасыщенные высокомолекулярные жирные кислоты с образованием сложных эфиров. Наиболее активна липоксигеназа в семенах сои. Из всех ненасыщенных жирных кислот липоксигеназа окисляет с достаточной скоростью линолевую и линоленовую кислоты, олеиновая к-та окисляется медленнее.
Трансферазы - Ферменты катализирующие перенос отдельных радикалов, частей молекул и даже целых молекул от одних соединений на другие. В зависимости от того, какие атомные группировки или радикалы переносятся трансферазами, все ферменты этого класса делятся на следующие группы:
переносят одно....
RR1 + HOH = ROH + R1H
Гидролазы делятся несколько подгрупп:
Пептидазы - расщепление пептидных связей
Эстеразы - реакции ращепления и синтеза сложных эфиров.
Липазы - расщепление жиров
Фосфатазы - гидролиз сложных эфиров фосфорной кислоты
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 881; Нарушение авторских прав?; Мы поможем в написании вашей работы!