
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение вещества
|
|
|
|
Гомогенные и гетерогенные системы. Скорость гомогенных и гетерогенных реакций. Зависимость скорости реакции от концентрации реагирующих веществ. Зависимость скорости реакции от температуры. Химическое равновесие. Константа равновесия. Принцип Ле Шателье.
ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Химическая кинетика изучает скорость химических процессов, которые могут протекать в гомогенной или гетерогенной системах.
Система – вещество или совокупность веществ, реально или мысленно отделенных от окружающей среды.
Гомогенная система – система, состоящая из одной фазы (например, водный раствор хлорида натрия). Отсутствует граница раздела между веществами.
Гетерогенная система – система, состоящая из нескольких фаз (например, смесь воды и масла). Вещества имеют между собой границу раздела.
Скорость гомогенной реакции – количество вещества, вступившего в реакцию или образующегося при реакции за единицу времени, в единице объёма системы
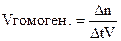
Скорость гетерогенной реакции – количество вещества, вступившего в реакцию или образующегося при реакции за единицу времени на единице площади раздела фаз
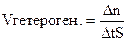
где ∆n – изменение количества вещества
∆t – время реакции
V – объём гомогенной системы
S – площадь раздела фаз в гетерогенной системе
Зависимость скорости реакции от концентрации реагирующих веществ отражена в законе действующих масс: «при постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ в степенях соответствующих им стехиометрическим коэффициентам».
Например, для реакции:
2SO2(Г) + O2(Г) ↔ 2SO3(Г)
скорость прямой реакции выражается уравнением:
 - кинетическое уравнение реакции,
- кинетическое уравнение реакции,
где [SO2], [O2]– концентрации SO2 и O2
К- константа скорости прямой реакции;
скорость обратной реакции: 
Физический смысл константы скорости в том, что при концентрации веществ равных единице V = K, т.е. константа скорости характеризует скорость химического процесса и зависит только от природы реагирующих веществ и температуры.
Для гетерогенных систем в уравнение зависимости (кинетическое уравнение) входят концентрации только тех веществ, которые находятся в растворенном или газообразном состоянии, так как для твёрдых веществ концентрация вещества на поверхности остается постоянной.
Например, для реакции:
С(ТВ) + О2(Г) = СО2(Г)
Кинетическое уравнение запишется:
 , но т.к. [C] = const
, но т.к. [C] = const
 , где
, где  ЭФ=
ЭФ=  [C]
[C]
Зависимость скорости реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
 ,
,
где 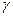 – температурный коэффициент
– температурный коэффициент
Vt2,Vt1 -скорости реакции при температуре t2 и t1
Пример 1. Вычислить, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 500 до 800С, если температурный коэффициент реакции равен 3


Следовательно, скорость реакции возрастёт в 27 раз.
Пример 2. Во сколько раз изменится скорость прямой реакции при уменьшении объёма в 4 раза в системе:
2СО(г) + О2(г) = 2СО2(г)
Кинетическое уравнение прямой реакции:
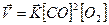
Система гомогенная и газофазная, поэтому при уменьшении объёма в системе в 4 раза, концентрация каждого из реагирующих веществ увеличится в 4 раза. При новых концентрациях кинетическое уравнение:

Отсюда 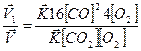 = 64
= 64
Следовательно, скорость прямой реакции возрастёт в 64 раза.
В большинстве случаев химические реакции протекают как в прямом, так и в обратном направлениях (обратимые реакции). В обратимых процессах прямая и обратная реакция протекают одновременно в противоположных направлениях.
Например, для реакции:
СО(Г) + Н2О(Г) = СО2(г) + Н2(г)
Кинетическое уравнение для прямой реакции:

Кинетическое уравнение для обратной реакции:
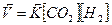
Состояние, при котором скорости прямой и обратной реакции равны ( ), называется состоянием химического равновесия. При химическом равновесии обе реакции продолжают протекать, и в системе при этом присутствуют и реагенты, и продукты
), называется состоянием химического равновесия. При химическом равновесии обе реакции продолжают протекать, и в системе при этом присутствуют и реагенты, и продукты
 =
= 
 ,
,
где K-константа равновесия;
[CO2], [H2], [CO], [H2O]– равновесные концентрации веществ в системе.
Если К>1, в системе преобладают продукты – равновесие смещено в сторону прямой реакции.
Если К<1, в системе преобладают реагенты – равновесие смещено в сторону обратной реакции.
Состояние химического равновесия зависит от:
- концентрации веществ;
- температуры системы;
- давления системы (для газофазных реагентов и продуктов).
При изменении параметров системы нарушается состояние химического равновесия. Переход системы из одного равновесного состояния в другое называется смещением химического равновесия.
Направление смещения химического равновесия определяется принципом Ле Шателье: «если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдёт в другое состояние равновесия так, чтобы уменьшить эффект внешнего воздействия».
Пример 3. Экзотермическая реакция сгорания водорода в кислородепротекает по уравнению:
2Н2(г) + О2(г) = 2Н2О(г) ∆Н<0
Как надо изменить а) температуру; б) концентрацию исходных веществ; в) давление, чтобы сместить равновесие в сторону прямой реакции?
Из принципа Ле Шателье следует, что смещение равновесия достигается:
а) увеличением концентрации исходных веществ;
б) понижением температуры системы, так как прямая реакция идёт с выделением тепла (нагревом системы);
в) увеличением давления в системе, так как прямая реакция идёт с уменьшением давления (из трёх моль газа образуется два моль газообразных продуктов).
КОНТРОЛЬНЫЕ ЗАДАНИЯ
37.Как изменится скорость реакции окисления оксида азота (II): 2NО(Г) + O2(Г) = 2NО2(Г), если концентрацию NО увеличить в 2раза, а концентрацию кислорода уменьшить в 2 раза?
38.На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в газовой фазе реакции возросла в 27 раз.
39.Как следует изменить температуру и давление, чтобы повысить выход продуктов реакции: CaCO3(TB) = CaO(TB) + CO2(Г),  = 179 кДж.
= 179 кДж.
40.В системе: CO2(Г) + 2H2(Г) = С(ТВ) + 2H2O(Г) концентрацию СО2 увеличили от 0,03 до 0,12 моль/л, а концентрацию Н2 увеличили от 0,06 до 0,24 моль. Во сколько раз изменится скорость реакции?
41.Реакция протекает до конца при 1000С за 20с. Сколько времени будет протекать реакция при 200С, если температурный коэффициент равен 2?
42.В каком направлении сместится равновесие в системе: Н2О(Г) +СО(Г) = СО2(г) + Н2(г) ( = 94 кДж), если давление увеличить в 2 раза и одновременно повысить температуру.
= 94 кДж), если давление увеличить в 2 раза и одновременно повысить температуру.
43.Как изменится скорость реакции, если общее давление в системе: СН4(Г) + 2О2(Г) = СО2(Г) + 2Н2О(Г) уменьшить в 5 раз.
44.Чему равен температурный коэффициент реакции, если при повышении температуры на 600 скорость реакции возросла в 64 раза?
45.В системе:3Fe(TB) +4H2О(Г) = Fe3О4(TB)+4H2(Г) (∆Н > 0) необходимо сместить равновесие влево. Как изменить для этого параметры системы?
46.Найти значения константы скорости реакции: 2CO2(г) + O2(Г) ↔ 2CO2(Г), если при концентрации CO равной 0,05 моль/л, концентрации O2 равной 0,01 моль/л скорость реакции равна 5·10-5 моль/л·мин.
47. При 3930К реакция заканчивается за 10 мин. Сколько времени будет продолжаться реакция при 3630К, если температурный коэффициент реакции равен 3?
48. Почему при изменении давления смещается равновесие реакции 2SO2(Г) + O2(Г) = 2SO3(Г) и не смещается равновесие для реакции
S(ТВ) + O2(Г) = SO2(Г)? Написать выражение констант равновесия для данных систем через концентрации веществ.
49.Как изменится скорость реакции: 2S(ТВ) + 3O2(Г) = 2SO3(Г), если увеличить давление системы в 3 раза.
50.Во сколько раз медленнее протекает реакция в газовой фазе, если понизить температуру от 1000 до 400.Температурный коэффициент равен 2.
51 Указать направление смещения равновесия: а) при увеличении температуры системы, б) при увеличении давления в системе, в) при увеличении концентрации продуктов в системе для реакции: С3Н8(Г) + 5О2(Г) = 3СО2(Г) + 4Н2О(Г), ∆Н < 0.
52 Для реакции: СН4(Г) + 2О2(Г) = СО2(Г) + 2Н2О(Г) определить, во сколько раз следует увеличить концентрацию кислорода, чтобы при уменьшении концентрации метана (СН4) в девять раз скорость прямой реакции не изменилась.
53 При температуре 300С реакция протекает за 36 мин., а при 500-за 4мин. Рассчитайте температурный коэффициент реакции.
54. Напишите выражение для константы равновесия в системе CO2(г) + С(ТВ) ↔ 2CO(Г),. Как изменится скорость прямой реакции, если концентрацию CO2 уменьшить в 4 раза? Как надо изменить давление, чтобы повысить выход СО?
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 623; Нарушение авторских прав?; Мы поможем в написании вашей работы!