КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полярность молекулы
|
|
|
|
Полярность.
В зависимости от расположения общей электронной пары (электронной плотности) между ядрами атомов различают неполярную и полярную связь.
Неполярная связь образуется атомами элементов с одинаковой электроотрицательностью. Электронная плотность распределяется симметрично относительно ядер атомов.
Связь между атомами с различной электроотрицательностью называется полярной. Общая электронная пара смещена в сторону более электроотрицательного элемента. Центры тяжести положительных (б+) и отрицательных (б-) зарядов не совпадают. Чем больше разность электроотрицательности элементов образующих связь, тем выше полярность связи. При разности электроотрицательности меньше 1,9 связь считается полярной ковалентной.
Для двухатомной молекулы полярность молекулы совпадает с полярностью связи. В многоатомных молекулах общий дипольный момент молекулы равен векторной сумме моментов всех её связей. Вектор диполя направлен от + к –
Пример 3. Используя метод валентных связей, определите полярность молекул хлорида олова (II) и хлорида олова (IV).
50Sn относится к р – элементам.
Валентные электроны 5s25p2. Распределение электронов по квантовым ячейкам в нормальном состоянии:
|
|
|
|
s p
|
|
|
|
s p
|
|
|
|
s p
Химические формулы хлорида олова (IV) -SnCl4, хлорида олова (II) – SnCl2
Для построения геометрической формы молекул изобразим орбитали неспаренных валентных электронов с учётом их максимального перекрывания
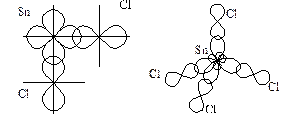
Рис. 4. Геометрическая форма молекул SnCl2 и SnCl4
Электроотрицательность Sn – 1,8. Cl – 3,0. Связь Sn – Cl, полярная, ковалентная. Изобразим вектора дипольных моментов полярных связей.
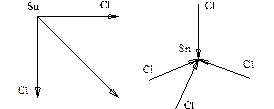
Рис. 5. Направление векторов дипольных моментов
в молекулах SnCl2 и SnCl4
SnCl2 – полярная молекула
SnCl4 – неполярная молекула.
Вещества в зависимости от температуры и давления могут существовать в газообразном, жидком и твёрдом агрегатном состоянии.
В газообразном состоянии вещества находятся в виде индивидуальных молекул.
В жидком состоянии в виде агрегатов, где молекулы связаны межмолекулярными силами Ван–дер–Ваальса или водородной связью. Причём, чем полярнее молекулы, тем прочнее связь и, как следствие, выше температура кипения жидкости.
В твёрдых телах структурные частицы связаны как внутримолекулярными, так и межмолекулярными связями. Классифицируют: ионные, металлические, атомные (ковалентные), молекулярные кристаллы и кристаллы со смешанными связями.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
73. Почему элементы хлор и калий являются активными, а элемент аргон, находящийся между ними, относится к малоактивным?
74. Используя метод валентных связей, объяснить почему молекула воды (Н2О) является полярной, а молекула метана (СН4) неполярной?
75. Вещество оксид углерода (II) является активным веществом, а оксид углерода (IV) относят к малоактивным веществам. Объяснить, используя метод валентных связей.
76. Как изменяется прочность молекул азота и кислорода. Объяснить, используя метод валентных связей.
77. Почему свойства кристалла хлорида натрия (NaCl) отличаются от свойств кристалла натрия (Na)? Какой вид связи осуществляется в этих кристаллах?
78. Используя метод валентных связей, определить полярность молекул хлорида алюминия и сероводорода.
79. К какому типу гидроксидов относится гидроксид рубидия? Объяснить, используя метод валентных связей.
80. Температура кипения жидкого фтороводорода равна 19,50С, а жидкого хлороводорода (- 84,00С). Почему такая большая разница в температурах кипения?
81. Используя метод валентных связей, объяснить, почему четырёххлористый углерод (ССl4) является неполярным, а хлороформ (СНСl3) полярным веществом?
82. Как изменяется прочность связей в молекулах СН4 – SnH4? Объяснить, используя метод валентных соединений.
83. Какие возможные соединения образуют элементы: свинец и бром? Определить полярность этих связей.
84. Используя метод валентных связей, определить полярность молекул азота и бромид азота (III).
85. Температура кипения воды равна 1000С, а сероводорода (60,70С). Почему такая большая разница в температурах кипения?
86. Определить, в каком соединении более прочная связь бромид олова или бромид углерода? Определить полярность этих соединений.
87. Используя метод валентных связей, определить полярность молекул йодид галлия и йодид висмута.
88. Используя теорию химической связи объяснить, почему ксенон относится к благородным (малоактивным) элементам.
89. Указать вид гибридизации (sp, sp2, sp3) в соединениях: BeCl2, SiCl4. Изобразите геометрические формы молекул.
90. Изобразите пространственное расположение связей в молекулах: гидрид бора и гидрид фосфора (III). Определить полярность молекул.
Методические указания к контрольным заданиям по дисциплине «Химия» для студентов нехимических специальностей заочной формы обучения. Часть 1.
Составители: доцент, к.х.н. Обухов В.М.
ассистент Костарева Е.В.
Подписано к печати Бумага писч. № 1
Заказ № Уч. изд. л.
Формат 60/90/ 1/16. Усл. печ. л.
Отпечатано на RISO GR 3750 Тираж экз.
Издательство «Нефтегазовый университет»
Государственное образовательное учреждение профессионального высшего образования
«Тюменский государственный нефтегазовый университет»
625000,г. Тюмень, ул. Володарского, 38
Отдел оперативной полиграфии издательства «Нефтегазовый университет»
625000,г. Тюмень, ул. Володарского, 38
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 6065; Нарушение авторских прав?; Мы поможем в написании вашей работы!