
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Переработка титановой губки в товарную продукцию 3 страница
|
|
|
|
Алюминий получают путем электролитического разложения глинозема, растворенного в расплавленном электролите (криолите – Na3AlF6).
Расплавленный криолит диссоциирует по следующей схеме:
Na3AlF6 ↔ 3 Na+ + AlF3-6
Глинозем, растворенный в расплавленном криолите, диссоциирует на алюминий и кислородсодержащие ионы. Диссоциацию глинозема можно представить в виде следующей схемы:
Al2 O3 ↔ 2 Al 3+ + 3 O2-
Если через расплавленный электролит пропустить постоянный ток, то на различных полюсах электроподводящих электродов будет происходит: выделение алюминия - на отрицательном электроде (катоде), кислорода – на положительном электроде (аноде).
На катоде в первую очередь разряжаются ионы А13 +, так как в электролите нет других более электроположительных ионов (а ионы натрия имеют более отрицательный потенциал).
Процесс электролиза проводят в электролизере, рис. 11.
Электролизер состоит из стального корпуса, футерованного внутри угольными блоками 9, в подовую часть которого с помощью шин 7 и токоподводящих стержней подведен отрицательный полюс источника тока.
Для того чтобы защитить токоподводящие стержни от разрушения на подину укладывают угольные блоки 9.
Над корпусом подвешены угольные аноды 3, к которым с помощью шин 2 подведен положительный полюс. Если в электролизер залить расплав 10, состоящий из криолита и глинозема, опустить в этот расплав аноды и пропускать через расплав постоянный ток большой силы и необходимого напряжения, то через определенное время на дне электролизера можно обнаружить расплавленный алюминий 8 под слоем расплавленного электролита 10, состоящего из криолита Na 3AIF6, в котором при температуре, близкой к 1000 °С, обычно растворено 1-10 % глинозема.
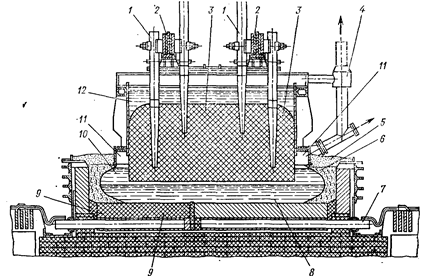
Рис. 11. Схема алюминиевого электролизера с верхним подводом тока к самообжигающемуся аноду:
1 - токоподводящие стержни; 2 - анодные шины; 3 - анодный угольный блок; 4 - газоотсосная система; 5 - слой глинозема;6 - гарнисаж; 7 - катодные шины; 8 - жидкий алюминий у катода; 9 - угольный катод; 10 - жидкий электролит; 11 - чугунный сборник анодных газов; 12 - твердожидкая анодная масса
Процесс электролиза сводится к разряду ионов Al3 + + О2 -, из которых состоит непрерывно расходуемый глинозем. Криолит не подвергается непосредственному электролизу и расходуется мало.
В результате чего на дне ванны образуется слой металлического алюминия 8. На аноде 3 преимущественно разряжаются ионы кислорода, который немедленно окисляет угольный анод, образуя СО и СО2.
Для того чтобы не происходило разрушение боковых графитовых блоков футеровки производят наращивание гарниссажа 6 из застывшего электролита и глинозема.
Электролит поддерживается в расплавленном состоянии только за счет теплоты, выделяющейся при прохождении через него электрического тока, поэтому часть электролита всегда настывает на холодных стенках и образует твердую застывшую корку, на которую сверху насыпают порошкообразную окись алюминия 5.
Алюминий извлекают из электролизера, пробивая корку электролита и опуская на дно футерованную огнеупором стальную трубку, через которую алюминий откачивают в вакуумный ковш.
По мере извлечения алюминия постепенно опускают анод и тщательно регулируют напряжение и межполюсное расстояние электролизера. Поскольку нижняя часть анода сгорает и он постепенно опускается, его необходимо наращивать в верхней части. В кожух анода систематически загружают анодную массу, которая постепенно коксуется на горячем конусе анода за счет теплоты, выделяющейся из ванны. Токоподводящие стальные штыри постепенно опускаются с анодом и во избежание их расплавления и загрязнения алюминия железом в очередной последовательности они выдергиваются из тела анода и поднимаются на более высокий уровень, а в образовавшуюся полость затекает анодная масса и затем коксуется.
3.5. Металлургия магния
3.5.1 Общие сведения о магнии
Магний - серебристо-белый металл. Важнейшее его физическое свойство -малая плотность, равная 1,738 г/см3 (при 20 °С).
При хранении магния в сухом воздухе на его поверхности образуется окисная пленка, предохраняющая металл при небольшом нагревании (до 200 °С) от дальнейшего окисления; в этих условиях коррозионная стойкость чистого магния превышает стойкость низкоуглеродистой стали. Однако во влажном воздухе его коррозия значительно усиливается. На него практически не действуют керосин, бензин и минеральные масла. Он не стоек в водных растворах солей (кроме фтористых) и растворяется во многих минеральных и органических кислотах.
Магний в виде слитков или изделий не огнеопасен. Возгорание магния может произойти лишь при температуре, близкой к точке его плавления (651 °С), или после расплавления, если он не изолирован от кислорода воздуха. Применение покровного флюса обеспечивает безопасное плавление и нагревание этого металла. Порошкообразный магний или тонкая магниевая лента легко загорается от спички и горит ослепительно белым пламенем. Магний немагнитен и не искрит при ударах или трении.
Предел прочности и другие механические свойства магния в большой степени зависят от его чистоты и способа приготовления образца (литой, деформированный); при температуре 20 °С Ств = 115 - 200 МПа (11,5 - 20 кгс/мм2), 6 = 8 - 11,5 %; НВ 30 - 36.
Как конструкционный материал магний не применяют из-за низких механических свойств. Наибольшее количество магния расходуют на приготовление его сплавов с другими металлами. Применяют магний и как раскислитель при получении некоторых тяжелых металлов, а также для изготовления различных реактивов. Порошок магния в смеси с окислителями широко используют для изготовления осветительных ракет, в фото- и кинотехнике.
Основное достоинство сплавов магния—их легкость (ρ = 1,8 кг/л). По прочности они уступают сплавам А1, хорошо воспринимая ударные нагрузки. Прекрасно обрабатываются резанием, шлифуются и полируются. Широко применяются в машиностроении там, где главное значение имеет масса (авиация, ракетная техника и др.).
Со многими металлами магний образует сверхлегкие сплавы. Распространены системы сплавов Mg—Al—Zn. Их механические свойства почти в два раза лучше, чем у металлического магния. Основные марки литейных сплавов магния МЛ4, МЛ5, МЛ12 содержат 5 – 9 % Al, 2 –5 % Zn, до 0,5% Мn, остальное - Mg.
3.5.2. Сырьевые источники магния
Магний - один из распространенных металлов в земной коре (по Виноградову -2,1 %). В свободном виде он не встречается, а является составляющей многих горных пород в виде карбонатов, силикатов или растворен в морской и озерной воде в виде хлоридов и сульфатов.
В настоящее время для получения магния применяют магнезит, доломит, карналлит, а также морскую воду и отходы ряда производств.
Магнезит - углекислый магний MgC03. Природный белый минерал – твердость 4-4,5; плотность – 2,2 – 3,14 г /см 3 магнезит обычно содержит карбонат кальция, кварц, а также примеси других минералов, включающих окислы алюминия и железа. Используется для производства огнеупоров и вяжущего материала в химической промышленности. Также является рудой для получения магния и его солей.

Рис. Магнезит
Для производства магния применяют только чистый каустический магнезит, полученный по реакции MgC03 == MgO + СО2 при нагревании (обжиге) природного магнезита до температуры 700 - 900 °С.
Доломит - горная порода, представляющая собой двойной карбонат кальция и магния MgC03*СаСО3, твердость 3,5 – 4,0; плотность 2,9 – 3,2 г/см3. Доломиты обычно содержат примеси кварца, кальцита, гипса и др. Доломит, так же как и магнезит, применяемый магниевой промышленностью, предварительно обжигают до получения смеси окислов MgO и СаО. Применяют доломит ьакже для производства огнеупоров, в химической промышленности, в производстве стекла.

Рис. Доломит
Карналлит КС1*MgCl2 * 6H2O - природный хлорид магния и калия - очень гигроскопичное кристаллическое вещество, обычно окрашенное примесями в розовый, желтый или серый цвет; твердость – 2,5; плотность 1,6 г/ см3.

Рис. Карналлит
Используется для получения магния, хлора и калийных солей.
Неисчерпаемые запасы магния (бишофита MgCl2* 6Н2О) находятся в морской воде; в среднем в 1 кг воды содержится 3,8 г MgCI2, 1,7 г MgS04 и 0,1 г MgBr. Морскую воду пока редко используют для получения бишофита, так как во многих странах имеются соляные озера, в воде которых содержание хлористого магния значительно выше, чем в морской воде. Кроме того, сырьем для получения магния теперь служат отходы ряда производств. При этом особенно широко используют хлористый магний, получаемый при извлечении титана.

Рис. Бишофит
3.5.3. Общие принципы производства магния
Металлический магний получают двумя способами: электролитическим и термическим.
Электролитический способ получения магния в настоящее время является основным. Этот метод предусматривает получение магния в несколько стадий, основными из которых являются: получение чистого безводного хлорида магния, электролиз расплавленного хлорида и рафинирование магния.

Рис.. Принципиальная технологическая схема получения магния электролитическим способом
 В зависимости от вида перерабатываемого сырья и способа получения хлорида возможны варианты технологических схем получения электролитического магния (рис. 161).
В зависимости от вида перерабатываемого сырья и способа получения хлорида возможны варианты технологических схем получения электролитического магния (рис. 161).
3.5.4. Получение безводного хлорида магния
Сырьем для получения безводного хлорида магния могут служить карналлит, бишофит и магнезит. Однако методы подготовки МgCl2 к электролизу из этих видов сырья различны.
Обезвоживание искусственного карналлита протекает по схеме:
MgCl2*KCl*6H2O ® MgCl2*KCl*2H2O® MgCl2*KCl
Первую стадию проводят в трубчатых вращающихся печах длиной 35 -40 м и диаметром 3,0 - 3,5 м при температуре на загрузочном конце печи ниже 120°С, а на разгрузочном - не выше 500 - 560 °С. При такой операции степень обезвоживания составляет 85 - 90 %. Обезвоженный в трубчатых печах карналлит содержит 6 - 8 % Н20 и до 2,5 % МgО.
Вторая стадия обезвоживания с целью полного удаления влаги и отстаивания MgO проводится путем плавки в стационарных карналлитовых печах непрерывного действия (СКН) или в хлораторах.
Безводный карналлита содержит, %: 49 – 51 MgCl2; 40 - 46 KCl; 6 – 7 NaCl;
0,5 – 1,0 MgO; 0,01 – 0,1 H2O.
3.5.5.Электролитический способ получения магния
Электролитическая сущность процесса электролитического получения магния заключается в следующем. В хлоридном расплаве в результате электролитической диссоциации образуются катионы металлов Mg2+, Na+, K+ и анионы хлора Cl-.
Под воздействием постоянного тока на катоде разряжаются только катионы по электролитической реакции
Mg2+ + 2 e ® Mg.
Анодный процесс сводится в разряду ионов хлора
2Cl- - 2 e ® Cl2
В процессе электролиза, проводимом при 690 – 7200 С, магний получают в жидком виде.
Процесс электролитического получения магния и хлора проводится в электролитической ячейке, представленной на рис. 13.4.

|
Рис. 13.4. Электролизер для получения магния:
1 - анод; 2 – катоды; 3 - диафрагма, отделяющая анодное и катодное пространства; 4 - труба для отвода хлора из анодного пространства; 5 - катодные шины
Анодами служат графитированные плиты 1, катодами - стальные пластины 2. Так как плотность расплавленного электролита больше, чем плотность магния при температуре электролиза, то выделяющийся на катоде жидкий магний, не растворяясь в электролите, в виде капель всплывает на его поверхность. На аноде выделяется газообразный хлор, который также поднимается и выбрасывается из электролита. Во избежание взаимодействия хлора и магния и короткого замыкания анода и катода расплавленным магнием вверху устанавливают перегородку, которую принято называть диафрагмой 3. Выделяющийся в анодном пространстве хлор отсасывают через трубы и используют, например, для хлорирования окиси магния или двуокиси титана.
Магниевые ванны соединяют последовательно в серии из 60 - 100 шт. Напряжение источника постоянного электрического тока на ванне колеблется в пределах 5,5 -7,5 В.
Извлекают магний из электролизера не реже одного раза в сутки с помощью вакуумного ковша. Извлеченный из ванн магний обычно содержит более 0,1 % примесей поэтому он всегда подвергается очистке.
3.6. Предприятия цветной металлургии Украины
3.6.1. Горно- обогатительные предприятия
3.6.1.1. «Иршанский горно- обогатительный комбинат» (п.г.т. Иршанск, Житомирская область).

Рис. – Обогатительная фабрика Иршинского ГОКа

(Что лучше?)
Продукция: ильменитовый концентрат, пески.
3.6.1.2. Вольногорский горно-металлургический комбинат
Комбинат включает в себя два основных передела: горно-обогатительный и металлургический.
Сырьевая база комбината представлена комплексными россыпями третичного возраста. Вскрышные породы представляют собой плотные зеленовато-серые и красновато-бурые глины, желтовато-бурые и палево-желтые лессовидные суглинки. Руда - это кварцевые мелкозернистые пески с содержанием глинистой фракции от 10 до 45% и суммы тяжелых минералов до 15-20%. Небольшая мощность вскрышных пород предопределила открытый способ разработки. Верхние горизонты карьеров отрабатываются вскрышными комплексами машин непрерывного действия в составе: роторных экскаваторов, системы конвейеров и отвалообразователей. Добыча рудных песков производится с применением шагающих и роторных экскаваторов с последующей подачей их на участок пульпоприготовления конвейерным и автомобильным транспортом.

(Убрать правую часnь)
 .
. 

Рис. Концентрат: рутиловый, цирконовый, ильменитовый,
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 1172; Нарушение авторских прав?; Мы поможем в написании вашей работы!