
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основные свойства
|
|
|
|
Строение карбоксильной группы предполагает наличие у карбоновых кислот сильных кислотных и слабых основных свойств. Кислотность карбоновых кислот как О-Н-кислот значительно выше, чем кислотность спиртов. Это объясняется бóльшей устойчивостью соответствующих им сопряженных оснований (карбоксилат-анионов) по сравнению с сопряженными основаниями спиртов (алкоксид-анионов), поскольку карбоксилат-анионы представляют собой частицы, в которых в результате p-π-сопряжения происходит делокализация отрицательного заряда, в то время как в обычных алкоксид-анионах стабилизация за счет сопряжения отсутствует. Поэтому кислотно-основное равновесие карбоновых кислот как О-Н-кислот сильнее сдвинуто вправо по сравнению со спиртами.
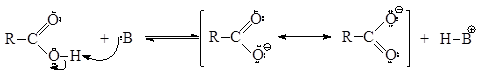 |
p-π-сопряжение в карбоксилат-анионе
Сила карбоновых кислот зависит от степени стабилизации сопряженного основания. Чем больше электронодонорный характер остатка, соединенного с карбоксильной группой, тем менее стабильно сопряженное кислоте основание и тем слабее кислота. Электроноакцепторные заместители уменьшают заряд на атоме кислорода, делая анион более энергетически устойчивым, что приводит к усилению кислотных свойств. Так, например, хлоруксусная кислота является более сильной, чем уксусная кислота. Ниже (табл. 2) приведены значения рКа для некоторых карбоновых кислот, которые иллюстрируют эту зависимость.
ТАБЛИЦА 2
Значения рКa некоторых карбоновых кислот
| Кислота | рКа | Кислота | рКа |
| НСООН | 3,75 | IСН2СООН | 3,16 |
| СН3СООН | 4,76 | BrСН2СООН | 2,90 |
| СН3СН2СООН | 4,87 | ClСН2СООН | 2,85 |
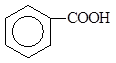
| 4,17 | Cl2СНСООН | 1,25 |
| Cl3ССООН | 0,66 |
В реакциях с основаниями карбоновые кислоты образуют соли, причем как достаточно сильные кислоты они могут реагировать и с сильными, и с относительно слабыми основаниями. В отличие от спиртов карбоновые кислоты реагируют с водными растворами щелочей и с карбонатами металлов. Последняя реакция может являться качественной, поскольку при этом выделяется углекислый газ.
 |
пропионовая кислота пропионат натрия

уксусная кислота ацетат натрия
 |
бензойная кислота бензоат аммония
Как достаточно сильные кислоты карбоновые кислоты реагируют с образованием солей и с активными металлами, например, со щелочными и щелочноземельными, а также и с другими металлами, например:
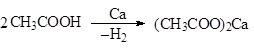 |
ацетат кальция
Как основания карбоновые кислоты могут реагировать только с очень сильными кислотами, например, с серной кислотой, при этом происходит протонирование по самому оснóвному атому кислорода:
 |
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 769; Нарушение авторских прав?; Мы поможем в написании вашей работы!