
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения. Сложные эфиры получают ацилированием спиртов и фенолов, причем в качестве ацилирующих агентов используются карбоновые кислоты
|
|
|
|
Сложные эфиры получают ацилированием спиртов и фенолов, причем в качестве ацилирующих агентов используются карбоновые кислоты, галогенангидриды карбоновых кислот и ангидриды карбоновых кислот (см. Спирты и Фенолы).
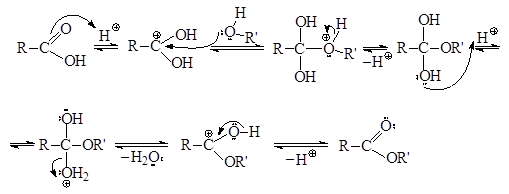 Взаимодействие карбоновых кислот со спиртами в кислой среде с образованием сложных эфиров называется реакцией этерификации. Это взаимодействие протекает по механизму нуклеофильного замещения, катализируемого кислотами. Спирты представляют собой слабые нуклеофилы, поэтому для протекания реакции необходим катализ. Основный катализ использовать нельзя, т.к. при этом карбоновая кислота перейдет в неактивную соль. Кислотный катализ обеспечивает увеличение электрофильности карбоновой кислоты, поскольку в присутствии более сильной кислоты-катализатора происходит протонирование с образованием положительно заряженной частицы.
Взаимодействие карбоновых кислот со спиртами в кислой среде с образованием сложных эфиров называется реакцией этерификации. Это взаимодействие протекает по механизму нуклеофильного замещения, катализируемого кислотами. Спирты представляют собой слабые нуклеофилы, поэтому для протекания реакции необходим катализ. Основный катализ использовать нельзя, т.к. при этом карбоновая кислота перейдет в неактивную соль. Кислотный катализ обеспечивает увеличение электрофильности карбоновой кислоты, поскольку в присутствии более сильной кислоты-катализатора происходит протонирование с образованием положительно заряженной частицы.
1 2 3 4
5 6
Каждая стадия этого многостадийного процесса является обратимой, поэтому весь процесс этерификации – обратимая реакция. Первая, третья, четвертая и шестая стадии представляют собой обычные кислотно-основные равновесия. Вторая стадия – это нуклеофильное присоединение молекулы спирта к протонированной форме карбоновой кислоты, а пятая стадия – отщепление молекулы воды. Протон как катализатор присоединяется к карбоновой кислоте на первой стадии и отщепляется от протонированной формы сложного эфира на последней стадии.
Реакционная способность карбоновых кислот и спиртов в реакции этерификации зависит от их электрофильных и соответственно нуклеофильных свойств. Так, например, хлоруксусная кислота подвергается этерификации легче, чем уксусная кислота. Из-за низкой нуклеофильности фенолы в реакцию этерификации не вступают (см. Фенолы). Кроме того, большое значение имеет стерический фактор: чем менее объемными являются R и R′, тем легче образуется продукт на стадии нуклеофильного присоединения. Поэтому лучше всего этерифицируются неразветвленные карбоновые кислоты и первичные спирты, а третичные спирты в условиях реакции этерификации подвергаются дегидратации.
Кроме реакции этерификации, для получения сложных эфиров используют взаимодействие спиртов или фенолов, а также алкоголятов или фенолятов с более сильными ацилирующими реагентами – с галогенангидридами или ангидридами карбоновых кислот. В случае ацилирования спиртов и фенолов галогенангидридами карбоновых кислот используется катализ основаниями, а при ацилировании ангидридами – и основаниями, и кислотами. При ацилировании алкоголятов и фенолятов катализ, естественно, не требуется, поскольку они представляют собой сильные нуклеофилы.
 |
ацетилхлорид этилацетат
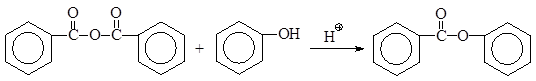 |
бензойный анигдрид фенилбензоат
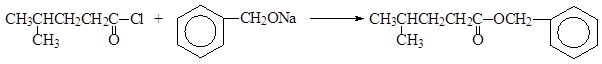 |
4-метилпентаноилхлорид бензил-4-метилпентаноат
Для получения сложных эфиров применяют и реакцию переэтерификации, в которой спирты ацилируются сложными эфирами. Переэтерификация может катализироваться, как и многие реакции ацилирования, как кислотами, так и основаниями. В кислой среде механизм переэтерификации аналогичен механизму этерификации.
 |
Равновесие этой реакции можно сдвинуть в нужную сторону, используя разницу в температурах кипения спиртов. Так, например, при нагревании метилбутаноата с 1-бутанолом в кислой среде постоянно проводят отгонку более летучего метанола, и равновесие смещается вправо.
 |
Сложные эфиры можно также получать алкилированием солей карбоновых кислот галогенопроизводными. Это взаимодействие является реакцией нуклеофильного замещения.
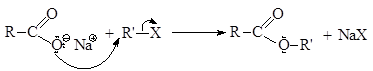 |
Так, например, по механизму SN2 происходит алкилирование бензоата натрия метилиодидом до метилбензоата.
 |
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 1092; Нарушение авторских прав?; Мы поможем в написании вашей работы!