
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции электрофильного замещения
|
|
|
|
Особенности химического поведения ароматических аминов
Выше уже отмечались некоторые особенности ароматических аминов:
§ взаимодействие с азотистой кислотой первичных ароматических аминов в отличие от первичных алифатических аминов приводит к образованию солей арилдиазония;
§ взаимодействие третичных ароматических аминов с азотистой кислотой протекает как электрофильное нитрозирование в ароматическое ядро.
Кроме реакции нитрозирования, ароматические амины легко вступают и в обычные реакции электрофильного замещения в ароматическое ядро. Аминогруппа, обладая положительным мезомерным эффектом, который превышает воздействие отрицательного индуктивного эффекта, является одним из самых сильных электронодонорных заместителей, активируя молекулу и направляя замещение в орто - и пара -положения. Реакционная способность ароматических аминов в реакциях электрофильного замещения настолько высока по сравнению с бензолом и его гомологами, что некоторые реакции могут быть осуществлены в более мягких условиях и не требуют катализа. Однако, основный характер и склонность первичных ароматических аминов к окислению делает условия проведения некоторых реакций ароматического электрофильного замещения для них неприемлемыми, так как некоторые реагенты являются сильными кислотами и окислителями. Кислоты, протонируя аминогруппу, превращают ее из активирующего заместителя в сильный дезактивирующий заместитель:
 |
+М>-I только –I-эффект
(активирущий, 1-го рода) (дезактивирующий, 2-го рода)
Бромирование. При взаимодействии анилина с бромной водой происходит электрофильное бромирование, причем реакционная способность анилина при введении одного атома брома, который является электроноакцепторным заместителем, в бензольное кольцо понижается незначительно, так что бромирование идет дальше до образования 2,4,6-триброманилина.
 |
Для понижения реакционной способности анилина и получения монобромзамещенного анилина используют предварительное ацетилирование до ацетанилида, в котором сохраняется ориентирующее действие заместителя (+М-эффект по-прежнему больше –I-эффекта), но из-за сопряжения неподеленной пары электронов на атоме азота не только с бензольным кольцом, но и с карбонильной группой донорные свойства заместителя уменьшаются. Ацетанилид подвергают действию бромной воды, при этом образуется практически только один продукт – пара -бромацетанилид, который гидролизом (в кислой или щелочной среде) может быть превращен в пара -броманилин.
 |
Сульфирование. Анилин при взаимодействии с концентрированной серной кислотой превращается в гидросульфат фениламмония, который при нагревании до 200О С в результате электрофильного сульфирования превращается в пара -аминобензолсульфокислоту, или сульфаниловую кислоту.
 |
Нитрование. Нитрование ароматических соединения обычно осуществляют смесью концентрированных азотной и серной кислот. Анилин в такой смеси существует практически полностью в виде соли фениламмония, поэтому его нитрование, если и происходит, то идет очень медленно и приводит к продукту мета -замещения. Однако при этом взаимодействии весьма существенными оказываются процессы деструктивного окисления анилина, что бывает заметно по обильному выделению оксидов азота. Поэтому нитрование анилина производят, предварительно «защитив» аминогруппу от воздействия кислой среды и окислителя ацетильной группой, которая резко понижает основность атома азота и предотвращает протонирование и окисление. После нитрования в обычных условиях образующийся как основной продукт пара -нитроацетанилид гидролизуют в кислой или щелочной среде до пара -нитроанилина.
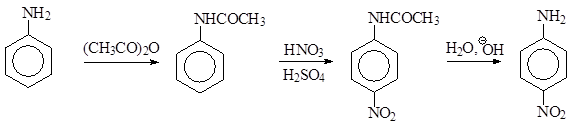 |
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 2942; Нарушение авторских прав?; Мы поможем в написании вашей работы!