
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Показатель степени при концентрации, входящей в кинетическое уравнение4
|
|
|
|
Общим кинетическим порядком реакции;
Б, г;
Если температура системы постоянна;
А, в;
Если концентрации реагирующих веществ постоянны и равны единице;
Концентрацией реагирующих веществ;
Скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении реакции;
А, г;
Гомогенной;
Все факторы;
Б, в;
В;
А, в;
Количество вещества, прореагировавшего в единицу времени в единице объема;
Производная от концентрации реагирующего вещества по времени в постоянном объеме;
3) пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в реакции;
4) изменение концентрации вещества за единицу времени в единице объема.
3. Что называют средней скоростью химической реакции?
2) производная от концентрации реагирующего вещества по времени в постоянном объеме;
3) пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в реакции;
4) изменение концентрации вещества за единицу времени в единице объема.
4. Какое уравнение можно использовать для вычисления средней скорости гомогенной реакции по изменению концентрации (с) или количества вещества (п) продуктов реакции: а) υ= 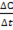 ; б) υ= -
; б) υ= - 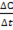 ; в) υ =
; в) υ = 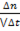 ; г) υ= -
; г) υ= - 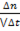
2) а, г;
3) б, в;
4) б, г.
5. Какое уравнение можно использовать для вычисления средней скорости гетерогенной реакции по изменению количества вещества исходных веществ: а) υ= - 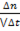 ; б) С
; б) С 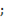 в) υ= -
в) υ= - 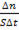 ; г) υ=
; г) υ= 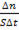
1) а, б;
2) г;
4) б.
6. какое уравнении можно использовать для вычисления средней скорости гомогенной реакции по изменению концентрации или количества вещества исходных веществ: а) υ= 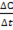 ; б)) υ= -
; б)) υ= - 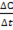 ; в) υ=
; в) υ= 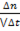 ; г) υ= -
; г) υ= - 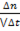 :
:
1) а;
3) а, г;
4) б, г.
7. Как изменяются скорости прямой и обратной реакции во времени от начала реакции?
1) прямой – увеличивается, обратной – уменьшается;
2) прямой– уменьшается, обратной– увеличивается;
3) прямой и обратной – увеличивается;
4) прямой и обратной– уменьшается.
8. Скорость химической реакции зависит от:
1) температуры, времени, концентрации;
2) природы реагирующих веществ, температуры, концентрации;
3) времени, температуры, концентрации, природы реагирующих веществ;
4) времени, температуры, концентрации.
9. Какие из следующих факторов влияют на скорость химической реакции: а) природа реагирующих веществ, б) концентрация реагирующих веществ, в) катализатор, г) растворитель, д) температура:
1) а, в, д;
2) а, б, в, д;
4) б, в, д.
10. скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности раздела фаз для реакций:
1) гомогенных;
2) гетерогенных;
3) протекающих в газовой фазе;
4) протекающих в твердой фазе.
11. скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема для реакции:
2) гетерогенной;
3) на границе твердое тело – жидкость;
4) на границе газ – жидкость.
12. Единицы измерения скорости химической реакции: а) мольл-1с-1, б) лмоль-1, в) смоль-1, г) мольл-1мин-1.
2) а;
3) б, в, г;
4) а, в.
13. Сформулируйте основной закон химической кинетики:
1) скорость сложной реакции, состоящей из ряда последовательных стадий, определяется скоростью самой медленной стадии;
3) скорость реакции определяется изменением числа реагирующих молекул в единицу времени в единице объема;
4) скорость реакции увеличивается при увеличении температуры.
14. Закон действующих масс устанавливает зависимость между скоростью химической реакции и:
1) температурой;
3) массой реагирующих веществ;
4) количеством реагирующих веществ.
15. От каких факторов зависит величина константы скорости химической реакции?
1) от времени реакции, температуры, катализатора;
2) от природы реакции, температуры, концентрации;
3) от природы реакции, температуры, катализатора;
4) от природы реакции и температуры.
16. Когда численное значение константы скорости и скорости совпадают?
2) если концентрации реагирующих веществ постоянны;
3) если реагирующие вещества и продукты реакции находятся в одной фазе;
4) никогда не совпадают.
17. Какие из перечисленных воздействий приведут к изменению константы скорости реакции: а) изменение температуры, б) изменение объема реакционного сосуда, в) введение в систему катализатора, г) изменение концентрации реагтрующих веществ.
2) б, г;
3) а, б, г;
4) а, в, г.
18. В каких случаях скорость реакции определяется изменением концентрации реагирующих веществ в единицу времени?
1) если давление в системе постоянное;
2) если объем системы постоянен;
4) если энергия системы постоянна.
19. Для какой реакции при изменении количества вещества А скорость не изменится: а) А(г)+В(г)→; б) 2А(г)+В2(г)→; в) 2А(Т)+2В(г)→; г) 3А(г)+ В2(г)→.
1) а;
2) в;
4) а, г.
20. Сумму показателей степеней при концентрациях, входящих в кинетическое уравнение называют?
2) молекулярностью реакции;
3) порядком реакции по веществу;
4) стехиометрическими коэффициентами.
21. Что называют порядком реакции по веществу?
2) сумму показателей степеней при концентрациях, входящих в кинетическое уравнение;
3) сумму стехиометрических коэффициентов реакции;
4) стехиометрический коэффициент вещества.
22. Что называют общим кинетическим порядком реакции?
1) показатель степени при концентрации, входящей в кинетическое уравнение;
2) сумму показателей степеней при концентрациях, входящих в кинетическое уравнение;
3) сумму стехиометрических коэффициентов реакции;
4) произведение показателей степеней при концентрациях, входящих в кинетическое уравнение.
23. Биохимические реакции, протекающие в организме человека, преимущественно относятся к реакциям:
1) 1 порядка;
2) 0 порядка;
3) 1 порядка, переходящие в 0 порядок;
4) 2 порядка.
24. Реакция радиоактивного распада относится к реакциям:
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 4183; Нарушение авторских прав?; Мы поможем в написании вашей работы!